Page 45 - 202016
P. 45
液中,使外周血中转氨酶含量显著上升,且不同类型肝
病所致转氨酶含量上升的程度也有明显差异 。SOD
[19]
和 GSH-Px 是细胞内天然的抗氧化物酶,能清除生物的
体内氧自由基,提升机体抗氧能力并阻断生物体内脂质
过氧化反应进程 。有研究表明,持续的氧化应激反应
[20]
会降低体内SOD、GSH-Px活性,从而导致脂质过氧化代
谢产物 MDA 含量升高,引起肝细胞变性、凋亡,其含量
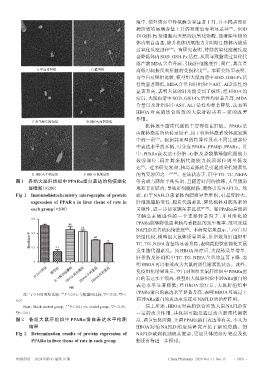
A.空白对照组 B.模型组 高低可间接反映肝脏的受损程度 。本研究结果表明,
[21]
与空白对照组比较,模型组大鼠血清中SOD、GSH-Px活
性均显著降低,MDA含量和肝组织中AST、ALT活性均
显著升高,表明大鼠的肝功能受到了破坏;经 HBOA 治
疗后,大鼠血清中SOD、GSH-Px活性均显著升高,MDA
含量以及肝组织中 AST、ALT 活性均显著降低,这表明
HBOA 对高脂饮食所致的大鼠肝损害有一定的改善
作用。
C.水飞蓟宾胶囊组 D.HBOA高剂量组
机体发生脂质代谢的主要部位在肝脏。PPARs 是
由配体激活的核转录因子,属于核甾体激素受体超家族
[22]
中的一员 。根据其亚型的特异性及在不同生理部位
中表达水平的不同,可分成PPARα、PPARβ、PPARγ。其
中,PPARα高表达于肝脏、心脏及骨骼肌等脂代谢能力
较强部位,而在其余脂代谢能力较弱部位则呈低表
[23]
达 。近来研究发现,胰岛素抵抗是引起脂质代谢紊乱
E. HBOA中剂量组 F. HBOA低剂量组 的首要原因之一 [24-26] 。在该状态下,肝中TG、TC、NEFA
图 1 各组大鼠肝组织中 PPARα蛋白表达的免疫组化 等合成与降解平衡失调,且随着时间的推移,大量脂肪
显微图(×200) 堆积于肝脏内,导致肝细胞损伤,最终引发NAFLD。然
Fig 1 Immunohistochemistry micrographs of protein 而,由于 NAFLD 患者体内脂质异常堆积,引起肝肿大,
expression of PPAR α in liver tissue of rats in 肝细胞脂肪变性、脂质代谢紊乱,降低机体对胰岛素的
each group(×200) 灵敏性,进一步加重胰岛素抵抗 [27-28] 。而 PPARα是能调
节胰岛素敏感性的一个重要转录因子,并且活化的
0.6
PPARα能够降低患者胰岛素抵抗的发生概率,故可延缓
##
## [29]
NAFLD患者的病情进展 。本研究结果显示,与空白对
0.4
蛋白表达水平 ## # 照组比较,模型组大鼠体质量增量、肝指数及肝组织中
TC、TG、NEFA含量均显著升高,表明高脂饮食能使大鼠
0.2
**
发生脂代谢紊乱。经 HBOA 治疗后,大鼠体质量增量、
肝指数及肝组织中 TC、TG、NEFA 含量均显著下降,表
0
明HBOA可以有效改善大鼠的脂代谢紊乱状态。此外,
HBOA中剂量组
水飞蓟宾胶囊组
空白对照组 模型组 HBOA高剂量组 HBOA低剂量组 免疫组化结果显示,空白对照组大鼠肝组织中PPARα蛋
白的表达水平很高,模型组大鼠肝组织中PPARα蛋白的
表达水平显著降低;经 HBOA 治疗后,大鼠肝组织中
组别
PPARα蛋白的表达水平显著升高,表明HBOA可通过上
注:与空白对照组比较, P<0.01;与模型组比较,P<0.05,P<
**
#
##
0.01 调PPARα蛋白的表达来发挥对NAFLD的治疗作用。
**
Note:blank control group, P<0.01;vs. model group,P<0.05, 综上所述,HBOA 对高脂饮食所致大鼠 NAFLD 有
#
## P<0.01 一定的改善作用,其机制可能是通过改善脂质代谢紊
图 2 各组大鼠肝组织中 PPARα蛋白表达水平检测 乱、调节氧化应激、上调PPARα蛋白表达等有关,本文为
结果 HBOA 防治 NAFLD 的后续研究开拓了新的思路。但
Fig 2 Determination results of protein expression of NAFLD 致病机制极其复杂,更加具体的治疗靶点及机
PPARα in liver tissue of rats in each group 制还有待进一步探讨。
中国药房 2020年第31卷第16期 China Pharmacy 2020 Vol. 31 No. 16 ·1959 ·