Page 33 - 202015
P. 33
醛固定 30 min 后,将 3% H2O2-甲醇混合液(1 ∶ 4,V/V)滴 150 150
在各组爬片上,室温孵育 30 min;以水洗 5 min×2 次,加 % 100 % 100
入 5%牛血清白蛋白(BSA)室温封闭 10 min;加入 P-gp 细胞存活率, 细胞存活率,
(1 ∶ 500)、LRP(1 ∶ 400)、BCRP(1 ∶ 400)一抗,4 ℃下孵育 50 50
过夜;以PBS清洗2 min×3次,滴加二抗(1∶1 000),37 ℃ 0 0
0 1 2 4 8 16 40 80 160 320 640 1 280
下孵育 30 min;以 PBS 清洗 2 min×3 次,用 DAB 显色试 质量浓度,μg/mL 质量浓度,μg/mL
A.索拉非尼 B.脱脂膏
剂盒显色(棕色)后加入水终止反应;用水清洗 5 min×3
150
次,加入苏木素复染40 s;将标本放入饱和Na2HPO4溶液
%
中浸泡 2 min,取出后立即用水清洗 5 min×3 次;用乙醇 100
梯度(50%、75%、85%、95%、100%)脱水,甘油封片。 细胞存活率, 50
光镜下观察各组细胞中 P-gp、LRP、BCRP 蛋白表达情
0
况,以细胞核有明显棕色或棕黄色颗粒为阳性表达。采 0 10 20 40 80 160
质量浓度,μg/mL
用Image J 6.0软件计算阳性细胞的平均光密度值。 C. CⅡ-3
2.8 美洲大蠊提取物对 HepG2/ADM 细胞中酶介导 图1 各组细胞的存活率测定结果(n=6)
MDR途径中相关基因mRNA及其蛋白的影响考察 Fig 1 Survival rate of cells in each group(n=6)
2.8.1 对酶介导MDR途径中相关基因mRNA表达的影
响 参照“2.7.1”项下方法测定细胞中 TopoⅡ、GST-π
mRNA 表达水平。其中,GST-π上游引物序列为 5′-
AGTCTCCTCGGTTCCCAAGCAA-3′,下游引物序列为 敏感组
5′-GGTGCTGGTTAAAGAGTTCGCC-3′,扩增产物大
小为132 bp;TopoⅡ上游引物序列为5′-TTAATGCTGC-
GGACAACAAACA-3′,下 游 引 物 序 列 为 5′-CGAC-
CACCTGTCACTTTCTTTT-3′,扩增产物大小为217 bp;
其余试验条件均与“2.7.1”项下相同。 耐药组
2.8.2 对酶介导MDR途径中相关蛋白表达的影响 参
照“2.7.2”项下方法检测细胞中Topo Ⅱ、GST-π蛋白表达
水平。其中,一抗的稀释比例均为1∶200;其余试验条件
均与“2.7.2”项下相同。
2.9 统计学方法 索拉非尼组
采用SPSS 19.0统计学软件进行数据分析。计量资
料以 x±s 表示,多组间比较采用单因素方差分析,两组
间比较采用t检验。P<0.05表示差异具有统计学意义。
3 结果
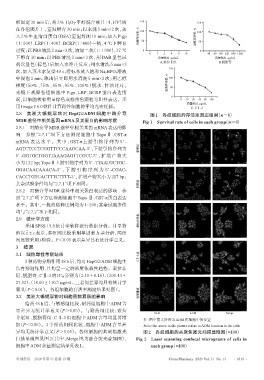
3.1 细胞毒性考察结果 CⅡ-3组
3种药物分别作用48 h后,均对HepG2/ADM细胞生
长有抑制作用,且均呈一定的浓度依赖性趋势。索拉非
尼、脱脂膏、CⅡ-3的IC20分别为(2.40±0.16)、(200.44±
27.52)、(18.00±1.82)μg/mL,三者间差异均具有统计学
意义(P<0.01)。各组细胞的存活率测定结果见图1。
3.2 美洲大蠊提取物对细胞药物累积的影响 脱脂膏组
给药48 h后,与敏感组比较,耐药组细胞中ADM含
量差异无统计学意义(P>0.05)。与耐药组比较,索拉
DAPI ADM Merge
非尼组、脱脂膏组、CⅡ-3 组细胞中 ADM 含量均显著增
注:图中箭头所指为ADM在细胞中的位置
加(P<0.05)。3 个给药组间比较,细胞中 ADM 含量差 Note:the arrow in the picture refers to ADM location in the cells
异均无统计学意义(P>0.05)。各组细胞的共聚焦激光 图2 各组细胞的共聚焦激光扫描显微图(×400)
扫描显微图见图2(其中,Merge图为融合荧光叠加图), Fig 2 Laser scanning confocal micrograms of cells in
细胞中ADM含量测定结果见表1。 each group(×400)
中国药房 2020年第31卷第15期 China Pharmacy 2020 Vol. 31 No. 15 ·1819 ·