Page 18 - 202009
P. 18
2.2 肺泡灌洗液中的中性粒细胞凋亡情况考察 料以 x±s 表示,多组间比较采用单因素方差分析,组间
ALI模型复制24 h后,麻醉小鼠,分离其气管,将导 两两比较采用SNK法。P<0.05为差异有统计学意义。
管插入支气管,注入 0.5 mL 生理盐水灌洗,并反复抽吸 3 结果
灌洗液,重复灌洗 5 次;收集灌洗液,以 250×g 离心 10 3.1 Res 对 ALI 模型小鼠肺泡灌洗液中的中性粒细胞
min,弃去上清液,沉淀加磷酸盐缓冲液(PBS,pH 7.2~ 凋亡的影响
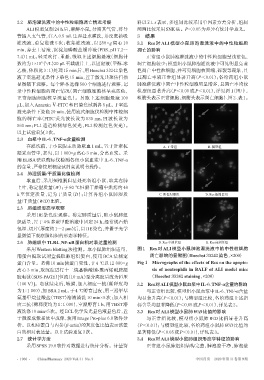
7.4)1 mL,轻柔吹打、重悬,吸取上述细胞悬液(细胞计 正常组小鼠肺泡灌洗液中的中性粒细胞呈浅蓝色,
数约为1×10 个/L)20 μL至载玻片上,以固定液(甲醇-冰 凋亡细胞较少;模型组小鼠肺泡灌洗液中可见明显亮蓝
5
乙酸,体积比3 ∶ 1)处理15 min后,用Hoechst 33242染色 色凋亡中性粒细胞,并可见细胞核固缩、碎裂等现象,且
液于室温避光条件下染色15 min,置于激光共聚焦扫描 其凋亡率较正常组显著升高(P<0.01);各给药组小鼠
显微镜下观察。每个样本选择 500 个细胞进行观察,记 肺泡灌洗液中凋亡中性粒细胞明显增多,且凋亡率均较
录中性粒细胞的凋亡情况(凋亡细胞细胞核呈亮蓝色, 模型组显著升高(P<0.05 或 P<0.01),详见图 1(图中,
正常细胞细胞核呈淡蓝色)。另取上述细胞悬液 100 粗箭头表示正常细胞,细箭头表示凋亡细胞)、图2、表1。
μL,加入Annexin Ⅴ-FITC和PI染色试剂各5 μL,于室温
避光条件下染色20 min,使用流式细胞仪检测中性粒细
胞的凋亡率(FITC 荧光波长设为 530 nm,PI 波长设为
560 nm;FL1 通道检测绿色荧光,FL3 检测红色荧光)。
以上试验重复3次。
2.3 血浆中IL-6、TNF-α含量检测
在灌洗前,于小鼠腹主动脉取血 1 mL,置于肝素抗 A. 正常组 B. 模型组
凝采血管中,摇匀,以1 000×g离心3 min,分离血浆。采
用 ELISA 法以酶标仪检测各组小鼠血浆中 IL-6、TNF-α
的含量,严格按照相应试剂盒说明书操作。
2.4 肺湿质量/干质量比值检测
取血后,采用颈椎脱臼法处死各组小鼠,取其右肺
上叶,称定湿质量(W);于80 ℃恒温干燥箱中烘烤约48
h 至恒定质量,记为干质量(D);计算各组小鼠肺湿质 C. 阳性对照组 D. Res低剂量组
量/干质量(W/D)比值。
2.5 肺组织形态学观察
采用 HE 染色法观察。称定肺质量后,取小鼠肺组
织适量,置于4%多聚甲醛溶液中固定24 h,经常规石蜡
包埋、切片(厚度约1~2 μm)后,以HE染色,并置于光学
显微镜下观察肺组织的形态学特征。
2.6 肺组织中TLR4、NF-κB蛋白相对表达量检测 D. Res中剂量组 E. Res高剂量组
采用 Western blotting 法检测。取小鼠肺组织适量, 图1 Res对ALI模型小鼠肺泡灌洗液中的中性粒细胞
用蛋白提取试剂盒提取肺组织蛋白,使用 BCA 法测定 凋亡影响的显微图(Hoechst 33242染色,×200)
蛋白含量。煮沸10 min使蛋白变性,于4 ℃以12 000×g Fig 1 Micrographs of the effects of Res on the apopto-
离心3 min,取沉淀进行十二烷基磺酸钠-聚丙烯酰胺凝 sis of neutrophils in BALF of ALI model mice
胶电泳(SDS-PAGE)[恒流(10 mA)至分离胶后改为恒压 (Hoechst 33242 staining,×200)
(100 V)]。电泳结束后,转膜,加入相应一抗(稀释度均 3.2 Res对ALI模型小鼠血浆中IL-6、TNF-α含量的影响
为1∶1 000),加BSA 2 mL,于4 ℃孵育过夜,用三羟甲基 与正常组比较,模型组小鼠血浆中IL-6、TNF-α含量
氨基甲烷盐酸盐(TBST)溶液清洗 10 min×5 次;加入相 均显著升高(P<0.01);与模型组比较,各给药组上述指
应二抗(稀释度均为1 ∶ 1 000),室温孵育1 h,用TBST溶 标含量均显著降低(P<0.05或P<0.01),详见表2。
液洗涤10 min×5次。经ECL化学发光显色液显色后,置 3.3 Res对ALI模型小鼠肺W/D比值的影响
于凝胶成像系统中成像,使用Image Pro-plus 6.0软件分 与正常组比较,模型组小鼠肺 W/D 比值显著升高
析。以相应蛋白与内参(β-actin)的灰度值比值表示该蛋 (P<0.01);与模型组比较,各给药组小鼠肺W/D比值均
白的相对表达量。以上试验重复3次。 显著降低(P<0.05或P<0.01),详见表3。
2.7 统计学方法 3.4 Res对ALI模型小鼠肺组织形态学特征的影响
采用SPSS 19.0软件对数据进行统计分析。计量资 正常组小鼠肺组织结构完整,肺泡腔干净,肺泡壁
·1036 · China Pharmacy 2020 Vol. 31 No. 9 中国药房 2020年第31卷第9期