Page 83 - 202005
P. 83
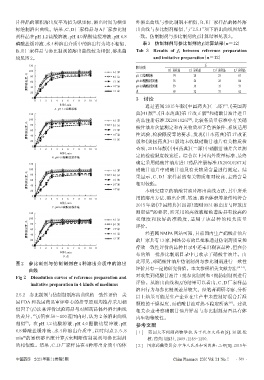
片样品的累积溶出度平均值为纵坐标、溶出时间为横坐 外溶出曲线与参比制剂不相似,B、E厂家样品的体外溶
标绘制溶出曲线。结果,C、D厂家样品与A厂家参比制 出曲线与参比制剂相似,与“2.5.1”项下溶出曲线图结果
剂样品在pH 1.2盐酸溶液、pH 4.0醋酸盐缓冲液、pH 6.8 一致。仿制制剂与参比制剂的f2计算结果见表3。
磷酸盐缓冲液、水4种溶出介质中的溶出行为均不相似, 表3 仿制制剂与参比制剂的f2计算结果(n=12)
B、E厂家样品与参比制剂的溶出曲线较为相似,溶出曲 Tab 3 Results of f2 between reference preparation
线见图2。 and imitative preparation(n=12)
120 f2
溶出介质
100 A厂家 B厂家样品 C厂家样品 D厂家样品 E厂家样品
% 80 B厂家 pH 1.2盐酸溶液 74 28 25 67
累积溶出度, 60 C厂家 pH 4.0醋酸盐缓冲液 76 26 28 84
pH 6.8磷酸盐缓冲液
79
39
35
71
D厂家
40
20 E厂家 水 69 32 37 62
0 3 讨论
0 1 2 3 4 5 6 7 8 9 10 11
时间,min 通过查阅 2015 年版《中国药典》(二部) 、《美国药
[2]
A. pH 1.2盐酸溶液
[8]
[3]
120 典》41版 、《日本药典》第17改正版 和硝酸甘油片进口
[4]
100 A厂家 药品注册标准 JX20010267 ,比较各质量标准中有关硝
% 80 B厂家
累积溶出度, 60 C厂家 酸甘油片含量测定和有关物质项下色谱条件、系统适用
性试验、检验限度等的要求,发现《日本药典》第17改正
D厂家
40
20 E厂家 版和《美国药典》41 版均未收载硝酸甘油片有关物质检
0
0 1 2 3 4 5 6 7 8 9 10 11 查项,2015年版《中国药典》(二部)中硝酸甘油片含量测
时间,min
B. pH 4.0醋酸盐缓冲液 定的检验限度较宽泛。综合以上国内外质量标准,最终
确定采用硝酸甘油片进口药品注册标准JX20010267对
120
100 A厂家 硝酸甘油片中硝酸甘油及有关物质含量进行测定。结
% 80 B厂家 果显示,C、D 厂家样品的有关物质相对较高,主药含量
累积溶出度, 60 C厂家 相对较低。
D厂家
40
20 E厂家 本研究建立的硝酸甘油片溶出曲线方法,其中所采
0
0 1 2 3 4 5 6 7 8 9 10 11 用的溶出方法、溶出介质、转速、溶出体积等条件均符合
时间,min 2015年版《中国药典》(四部)通则0931溶出度与释放度
C. pH 6.8磷酸盐缓冲液
[9]
120 测定法 的要求,所采用的高效液相色谱法具有较高的
100 A厂家 灵敏度和较好的准确度,适用于该品种的相关质量
% 80 B厂家 评价。
累积溶出度, 60 C厂家 经查阅NMPA网站可知,目前国内生产硝酸甘油片
D厂家
40
20 E厂家 的厂家共有13家,网站公布的已批准通过仿制药质量和
0
0 1 2 3 4 5 6 7 8 9 10 11 疗效一致性评价的品种目录中还未出现该品种,但在公
时间,min 布的第一批参比制剂目录中已收录了硝酸甘油片。由
D. 水
图 2 参比制剂与仿制制剂在 4 种溶出介质中的溶出 此可见,对硝酸甘油片仿制制剂与参比制剂进行一致性
曲线 评价具有一定的研究价值。本文参照相关文献方法 [10-14] ,
Fig 2 Dissolution curves of reference preparation and 对收集到硝酸甘油片1批参比制剂和4批仿制制剂进行
imitative preparation in 4 kinds of mediums 评价。从溶出曲线和 f2的结果可以看出,C、D 厂家样品
溶出行为与参比制剂差异较大。经笔者调研考察,分析
2.5.2 参比制剂与仿制制剂溶出曲线的一致性评价 美 以上结果可能是生产企业在生产中未控制好混合后湿
国FDA 和我国药品审评中心的指导原则均推荐采用相 颗粒的干燥温度,而硝酸甘油对热不稳定所致 。建议
[15]
似因子(f2 )法来评价试验药品与对照药品体外溶出曲线 相关企业考察硝酸甘油片样品与参比制剂是否具有体
的差异,当f2值在50~100范围内时,认为 2 条溶出曲线 内生物等效性。
[5]
相似 。在 pH 1.2 盐酸溶液、pH 4.0 醋酸盐缓冲液、pH 参考文献
6.8 磷酸盐缓冲液、水 4 种溶出介质中,以时间点 2、5、8 [ 1 ] 英国大不列颠药物学会.马丁代尔大药典[S]. 36 版.伦
min 的累积溶出度计算 f2来判断仿制制剂与参比制剂 敦:药典出版社,2009:1248-1250.
[6]
的相似性。结果,C、D厂家样品在4种溶出介质中的体 [ 2 ] 国家药典委员会.中华人民共和国药典:二部[S]. 2015年
中国药房 2020年第31卷第5期 China Pharmacy 2020 Vol. 31 No. 5 ·589 ·