Page 39 - 202004
P. 39
横坐标、其峰面积与内标峰面积之比(y)为纵坐标进行 积(A1 )。取同样的上述3种不同质量浓度的混合对照品
线性回归,并按信躁比计算定量限与最低检测限,结果 溶液于 37 ℃下以氮气流吹干,残渣用初始流动相 200
见表1。 μL复溶,使最终质量浓度与低、中、高质量浓度QC样品
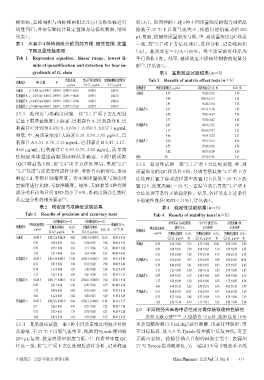
表1 天麻中4种待测成分的回归方程、线性范围、定量 一致,按“2.4”项下方法处理后,进样分析,记录峰面积
下限及最低检测限 (A2 )。基质效应=A1/A2×100%。每个质量浓度样品均
Tab 1 Regression equation,linear range,lowest li- 平行操作5次。结果,基质效应不影响待测物的定量分
mits of quantification and detection for four in- 析 ,详见表3。
[17]
gredients of G. elata 表3 基质效应试验结果(n=5)
线性范围, 定量下限(信噪比 最低检测限(信噪比 Tab 3 Results of matrix effect tests(n=5)
待测成分 回归方程 R 2
μg/mL 10∶1),μg/mL 3∶1),μg/mL
待测成分 理论质量浓度,μg/mL 基质效应(x±s),% RSD,%
天麻素 y=5.491 6x+2.340 7 0.999 4 0.030 9~63.12 0.030 9 0.010 1
天麻素 0.39 97.92±3.63 3.70
巴利森苷A y=0.375 0x-0.059 2 0.999 9 0.039 1~40.04 0.039 1 0.012 0 0.99 100.67±2.13 2.12
巴利森苷B y=0.055 0x+0.002 9 0.999 8 0.058 5~29.84 0.058 5 0.028 2
巴利森苷C y=0.045 4x+0.003 5 0.999 5 0.037 7~19.30 0.037 7 0.010 7 3.95 95.20±3.54 3.72
巴利森苷A 0.31 101.32±1.89 1.87
2.5.3 精密度与准确度试验 按“2.1.3”项下方法配制 0.78 97.83±8.57 7.76
定量下限质量浓度(天麻素、巴利森苷A、巴利森苷B、巴 3.13 97.50±6.42 6.58
巴利森苷B 0.47 90.97±7.23 7.95
利森苷C分别为0.030 9、0.039 1、0.058 5、0.037 7 μg/mL 1.17 102.41±5.33 5.21
和低、中、高质量浓度(天麻素 0.39、0.99、3.95 μg/mL,巴 4.66 99.54±2.30 2.31
利森苷 A 0.31、0.78、3.13 μg/mL,巴利森苷 B 0.47、1.17、 巴利森苷C 0.30 99.51±6.13 4.36
0.75 97.24±4.62 4.76
4.66 μg/mL,巴利森苷 C 0.30、0.75、3.02 μg/mL,质量浓 3.02 96.97±3.09 3.19
度根据本课题组前期预试验结果确定,下同)的质控 内标 20 87.31±7.85 5.13
(QC)样品各 5 份,按“2.4”项下方法处理后,再按“2.2” 2.5.5 稳定性试验 按“2.1.3”项下方法配制低、中、高
“2.3”色谱与质谱条件进样分析,考察日内精密度;连续 质量浓度的 QC 样品各 5 份,分别考察其按“2.4”项下方
测定 3 d,考察日间精密度。将实测质量浓度与理论质 法处理后置于自动进样器中放置 12 h 以及-20 ℃下放
量浓度进行比较,考察准确度。结果,天麻素等4种待测 置72 h、反复冻融(-20 ℃~室温)3次后再按“2.4”项下
成分的日内和日间RSD均小于8%,准确度符合生物样 方法处理等条件下的稳定性。结果,各样品在上述条件
[17]
品定量分析的相关要求 。 下稳定性良好(RSD<11%),详见表4。
表2 精密度与准确度试验结果 表4 稳定性试验结果(n=5)
Tab 2 Results of precision and accuracy tests Tab 4 Results of stability tests(n=5)
日内精密度(n=5) 日间精密度(n=15)
理论质量浓度, 准确度(x±s, 处理后在自动进样器 -20 ℃下放置72 h 反复冻融3次
待测成分 实测质量浓度 RSD, 实测质量浓度 放置12 h 后再处理 后再处理
μg/mL RSD,% n=5),% 待测成分 理论质量浓度,
(x±s),μg/mL % (x±s),μg/mL μg/mL 实测质量浓度 RSD, 实测质量浓度 RSD, 实测质量浓度 RSD,
天麻素 0.030 9 0.027 2±0.002 4 8.82 0.026 3±0.003 2 12.16 88.33±8.15 (x±s),μg/mL % (x±s),μg/mL % (x±s),μg/mL %
0.39 0.38±0.03 7.61 0.34±0.03 7.86 98.65±7.27 天麻素 0.39 0.36±0.02 5.55 0.37±0.04 10.81 0.39±0.03 7.69
0.99 0.99±0.04 3.63 1.15±0.06 5.10 108.69±3.02 0.99 1.08±0.03 2.78 0.98±0.05 5.10 1.05±0.07 6.67
3.95 3.51±0.08 2.26 3.65±0.08 2.31 100.87±4.65 3.95 3.87±0.04 1.03 3.79±0.18 4.75 3.82±0.12 3.14
巴利森苷A 0.039 1 0.035 4±0.004 1 11.58 0.032 2±0.003 1 9.63 90.13±7.89 巴利森苷A 0.31 0.32±0.03 9.37 0.33±0.03 9.09 0.29±0.03 10.34
0.31 0.31±0.02 7.38 0.31±0.02 7.38 98.09±2.86 0.78 0.86±0.05 5.81 0.83±0.07 8.43 0.79±0.07 8.86
0.78 1.13±0.04 3.83 1.30±0.08 5.96 96.52±6.47 3.13 3.23±0.09 2.78 3.08±0.12 3.89 2.97±0.09 3.03
3.13 3.67±0.18 5.07 3.26±0.08 2.31 92.59±1.37 巴利森苷B 0.47 0.49±0.03 6.12 0.46±0.04 8.69 0.49±0.04 8.16
巴利森苷B 0.058 5 0.051 7±0.004 3 8.32 0.052 6±0.003 8 7.22 87.65±9.18 1.17 1.02±0.04 3.92 0.96±0.06 6.25 1.15±0.05 4.34
0.47 0.51±0.04 6.96 0.49±0.03 6.77 103.08±4.18 4.66 4.34±0.13 3.23 4.58±0.31 6.76 4.03±0.16 3.97
1.17 0.99±0.07 6.89 0.92±0.05 5.60 97.23±2.16 巴利森苷C 0.31 0.28±0.03 10.71 0.32±0.03 9.37 0.26±0.02 7.69
4.66 4.12±0.03 3.82 4.08±0.23 5.80 91.05±3.29 0.75 0.73±0.04 5.48 0.77±0.04 5.19 0.79±0.06 7.59
巴利森苷C 0.037 7 0.032 8±0.002 9 8.84 0.036 2±0.004 3 11.88 86.16±7.17 3.02 2.92±0.14 4.79 3.11±0.12 3.85 2.82±0.09 2.34
0.3 0.26±0.01 4.41 0.25±0.02 7.22 88.83±3.82 2.6 不同粒径天麻粉中活性成分离体肠吸收特性研究
0.75 0.72±0.01 1.75 0.74±0.05 6.21 96.29±2.28
3.02 2.87±0.16 5.63 2.79±0.08 3.37 94.21±2.10 参照文献方法 [18-23] ,大鼠禁食12 h后,腹腔注射10%
2.5.4 基质效应试验 取3种不同质量浓度的混合对照 水合氯醛溶液(3.8 mL/kg)进行麻醉,迅速打开腹腔,剪
品溶液,于37 ℃下以氮气流吹干,残渣用Tyrode缓冲液 下目标肠段,放入 0 ℃ Tyrode 缓冲液中反复冲洗,直至
200 μL 复溶,使最终质量浓度与低、中、高质量浓度 QC 无肠内容物。将肠管插入自制的硅胶套管中,表面用
样品一致,按“2.4”项下方法处理后进样分析,记录峰面 37 ℃ Tyrode缓冲液冲洗,另一端用3/0号非吸收手术线
中国药房 2020年第31卷第4期 China Pharmacy 2020 Vol. 31 No. 4 ·417 ·