Page 74 - 《中国药房》2025年3期
P. 74
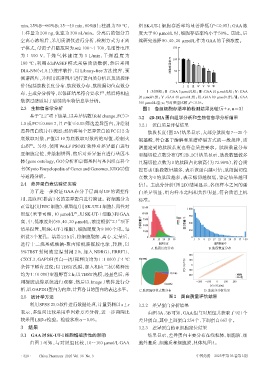
min,35%B→80%B;35~40 min,80%B);柱温为 50 ℃, 组 SK-UT-1 细胞存活率均显著降低(P<0.05);GAA 浓
上样量为 200 ng,流速为 300 nL/min。分离后的馏分真 度大于80 μmol/L时,细胞存活率均小于50%。因此,后
空离心浓缩后,采用质谱仪进行分析,检测方式为正离 续研究选择80、40、20 μmol/L作为GAA的干预浓度。
子模式,母离子扫描范围为m/z 100~1 700,毛细管电压 150
为 1 500 V,干 燥 气 体 速 度 为 3 L/min,干 燥 温 度 为
180 ℃;利用 ddaPASEF 模式采集质谱数据,然后采用 细胞存活率/% 100 a a a
DIA-NN(v1.8.1)搜库软件,以 Library-free 方法搜库,预 50 a a
测谱图库,并利用该谱图库进行蛋白质分析以及质控评
0
价(包括肽段长度分布、肽段数分布、肽段漏切位点数分 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ
[6]
布、主成分分析等,以保证结果符合要求) ,然后将相应 Ⅰ:对照组;Ⅱ:GAA 5 μmol/L组;Ⅲ:GAA 10 μmol/L组;Ⅳ:GAA
20 μmol/L组;Ⅴ:GAA 40 μmol/L组;Ⅵ:GAA 80 μmol/L组;Ⅶ:GAA
数据过滤后用于后续的生物信息学分析。 160 μmol/L组;a:与对照组比较,P<0.05。
2.3 生物信息学分析 图1 各组细胞存活率的检测结果比较(x±s,n=3)
基于“2.2”项下结果,以差异倍数(fold change,FC)≥ 3.2 4D-DIA蛋白组学分析和生物信息学分析结果
1.5或FC≤0.666 7,且P值≤0.05筛选差异蛋白,并绘制 3.2.1 蛋白质量评估结果
差异蛋白统计柱状图;然后将每个差异蛋白的FC以2为 肽段长度(图2A)结果显示,大部分肽段有7~20个
底数取对数,P 值以 10 为底数取对数的绝对值,绘制火 氨基酸,符合基于酶解和质谱碎裂方式的一般规律,质
[8]
山图 。另外,使用 WoLF PSORT 软件对差异蛋白进行 谱鉴定到的肽段长度也符合质控要求。肽段数量分布
亚细胞定位,并绘制饼图,然后对差异蛋白进行基因本 和漏切位点数分布(图2B、2C)结果显示,肽段数量较多
体(gene ontology,GO)分析和京都基因与基因组百科全 且漏切位点数为0的肽段占比较高(为72.99%),符合质
书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信 控要求(肽段数量越多,表示该蛋白越可信;肽段漏切位
号通路分析。 点数为 0 的肽段越多,表示酶切越彻底,鉴定结果越可
2.4 差异蛋白表达验证实验 信)。主成分分析(图2D)结果显示,各组样本之间的蛋
为了进一步验证 GAA 在分子层面对 UF 的调控作 白差异明显,组内样本之间相关性明显,符合质谱上机
用,选取FC排前3名的差异蛋白进行验证。将细胞分为 标准。
正常组(用EEC细胞)、模型组(用SK-UT-1细胞)、阳性对 12 500
1 000
[9]
照组(米非司酮,10 μmol/L ,用 SK-UT-1 细胞)和 GAA 10 000 750
高、中、低浓度组(80、40、20 μmol/L,浓度根据“2.1”项下 肽段数量/个 7 500 Charge 蛋白数量/个 500
2
3
4
5 000
结果设置,用SK-UT-1细胞),细胞密度为8 000个/孔,每 250
2 500
组设3个复孔。培养24 h后,将细胞裂解、离心、定量后, 0 0
10 15 20 25 30 1 5 9 13 17 21 25 29 33 37 >40
进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,以 肽段长度 肽段数量/个
A.肽段长度分布 B.肽段数量分布
5%TBST 封闭液室温封闭 2 h,加入 NDRG1、ERRFI1、
200
CXCL3、GAPDH蛋白一抗(稀释度均为1∶1 000)于4 ℃ 0(72.99%) 100
条件下孵育过夜;以 TBST 洗膜,加入相应二抗(稀释度 PC2 (25.27%) -100 0
均为1∶10 000)室温孵育2 h;以TBST洗膜,经显色后,采 2(3.21%) -200 对照组
GAA组
用凝胶成像系统进行观察,然后以 Image J 软件进行分 -200 -100 0 100 200
1(23.80%)
PC1(47.36%)
析,以GAPDH蛋白为内参,计算各目的蛋白的表达水平。 C.肽段漏切位点数分布 D.主成分分析结果
2.5 统计学方法 图2 蛋白质量评估结果
利用SPSS 25.0软件进行数据处理,计量资料以x±s 3.2.2 差异蛋白分析结果
表示,多组间比较采用单因素方差分析,进一步两两比 由图3A、3B可知,GAA组与对照组共获取了921个
较采用LSD-t检验。检验水准α=0.05。 差异蛋白,其中上调蛋白254个、下调蛋白667个。
3 结果 3.2.3 差异蛋白的亚细胞定位结果
3.1 GAA对SK-UT-1细胞增殖活性的影响 结果显示,差异蛋白主要分布在线粒体、细胞核、细
由图 1 可知,与对照组比较,10~160 μmol/L GAA 胞外基质、细胞质和细胞膜,具体见图4。
· 320 · China Pharmacy 2025 Vol. 36 No. 3 中国药房 2025年第36卷第3期