Page 62 - 《中国药房》2024年23期
P. 62
式进行正离子扫描,扫描时间为 200 ms;喷雾电压为 4 2 000
CBD组
kV;雾化温度为500 ℃;雾化气流速为40 L/min;气帘气 1 500 CBD-CCMC纳米胶束组
流速为 20 L/min;碰撞气压力为 medium;辅助气流速为 ( ng/mL )
50 L/min。用于定量分析的离子对质荷比(m/z)为315.2→ 1 000
193.2(CBD)、256.1→167.1(内标)。 质量浓度/
2.2.4 标准曲线 500
以CBD对照品质量浓度为横坐标(X)、CBD和苯海 0
0 10 20 30 40 50
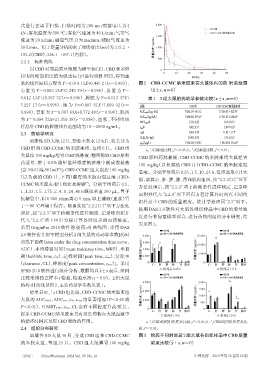
拉明的峰面积比值为纵坐标(Y)进行线性回归,得到血 时间/h
浆的线性回归方程为Y=0.018 12X+0.445 21(r=0.993)、 图2 CBD-CCMC纳米胶束在大鼠体内的药-时曲线图
心脏为 Y=0.003 25X+3.242 49(r=0.996)、肝脏为 Y= (x±s,n=6)
0.012 43X+10.387 32(r=0.996)、脾脏为 Y=0.013 47X+ 表1 2组大鼠的药动学参数比较(x±s,n=6)
7.227 17(r=0.995)、肺 为 Y=0.007 51X+7.669 32(r= 参数 CBD组 CBD-CCMC纳米胶束组
0.996)、肾脏为 Y=0.007 69X+9.772 49(r=0.998)、肌肉 AUC 0-48 h/(μg·h/L) 7 086.35±343.12 17 296.92±562.79 a
AUC 0-∞/(μg·h/L) 7 440.44±493.19 17 351.87±649.62 a
为 Y=0.004 72X+21.350 38(r=0.998),血浆、不同组织
MRT 0-48 h/h 7.52±0.23 8.16±0.19
样品中CBD的检测线性范围均为10~2000 ng/mL。 t max/h 1.00±0.11 2.00±0.22
2.3 药动学研究 t 1/2/h 5.88±0.79 11.07±1.17 b
CL/[L/(h·kg)] 13.44±0.76 5.76±0.12
取雄性SD大鼠12只,禁食不禁水12 h后,将其分为 c max/(μg/L) 1 596.34±139.87 1 942.40±131.64 b
CBD 组和 CBD-CCMC 纳米胶束组,每组 6 只。CBD 组 a:与CBD组比较,P<0.05;b:与CBD组比较,P<0.01。
大鼠按100 mg/kg灌胃CBD混悬液:精密称取CBD原料 CBD 原料药混悬液,CBD-CCMC 纳米胶束组大鼠灌胃
药适量,溶于 0.5% 羧甲基纤维素钠溶液中制成混悬液
100 mg/kg(以负载的 CBD 计)CBD-CCMC 纳米胶束混
[含 3% 吐温 80(m/V)];CBD-CCMC 组大鼠按 100 mg/kg
悬液。分别于给药后0.25、1.5、10、24 h,每组选取6只大
(以负载的 CBD 计,下同)灌胃纳米胶束混悬液:CBD-
鼠,取其心、肝、脾、肺、肾和肌肉组织,按“2.2.2(2)”项下
[7]
CCMC纳米胶束用生理盐水溶解 。分别于给药后0.5、
方法处理后,按“2.2.3”项下检测条件进样测定,记录峰
1、1.33、1.5、1.75、2、4、8、24、48 h 眼眶采血 300 μL,置于
面积并代入“2.2.4”项下回归方程计算各时间点不同组
抗凝管中,以6 000 r/min离心5 min,取上清液(血浆)置
织样品中 CBD 的质量浓度。统计学处理同“2.3”项下。
于-80 ℃环境中保存。取血浆按“2.2.2(1)”项下方法处
使用 DAS 2.0 软件对大鼠各组织样品中 CBD 的质量浓
理后,按“2.2.3”项下检测条件进样测定,记录峰面积并
度进行非房室模型拟合,进行药物的组织分布研究,结
代入“2.2.4”项下回归方程计算各时间点的血药浓度。
果见图3。
采用 OriginPro 2018 软件绘制药-时曲线图,采用 DAS
CBD组 CBD组
2.0软件按非房室模型分析2组大鼠的药动学参数[药时 8 000 CBD-CCMC纳米胶束组 15 000 a CBD-CCMC纳米胶束组
曲线下面积(area under the drug concentration time curve, ( ng/mL ) 6 000 a a a ( ng/mL ) 10 000
AUC)、平均滞留时间(mean residence time,MRT)、半衰 4 000
期(half-life time,t1/2 )、达峰时间(peak time,tmax )、清除率 质量浓度/ 2 000 质量浓度/ 5 000
(clearance,CL)、峰浓度(peak concentration,cmax )]。采用 0 心 肝 脾 肺 肾 肌肉 0 心 肝 脾 肺 肾 肌肉
SPSS 20.0软件进行统计分析,数据均以x±s表示,组间 A.给药后0.25 h B.给药后1.5 h
CBD组 CBD组
比较采用独立样本 t 检验,检验水准 α=0.05。2 组大鼠 CBD-CCMC纳米胶束组 CBD-CCMC纳米胶束组
6 000 2 000 a
的药-时曲线见图2,主要药动学参数见表1。
结果显示,与CBD组比较,CBD-CCMC纳米胶束组 ( ng/mL ) 4 000 ( ng/mL ) 1 500 a
1 000
大鼠的 AUC0-48 h、AUC0-∞、t1/2、cmax均显著增加(P<0.05 或 质量浓度/ 2 000 质量浓度/ 500 b
P<0.01),且 MRT0-48 h、tmax、CL 也有不同程度升高/延长,
0 0
心 肝 脾 肺 肾 肌肉 心 肝 脾 肺 肾 肌肉
提示CBD-CCMC纳米胶束具有延长药物在大鼠血液中 C.给药后10 h D.给药后24 h
的循环时间以及促CBD吸收的作用。 a:与CBD组同组织样品比较,P<0.01;b:与CBD组同组织样品比
2.4 组织分布研究 较,P<0.05。
取雄性 SD 大鼠 48 只,分成 CBD 组和 CBD-CCMC 图3 给药不同时间后2组大鼠各组织样品中CBD质量
纳米胶束组,每组 24 只。CBD 组大鼠灌胃 100 mg/kg 浓度比较(x±s,n=6)
· 2892 · China Pharmacy 2024 Vol. 35 No. 23 中国药房 2024年第35卷第23期