Page 91 - 《中国药房》2024年12期
P. 91
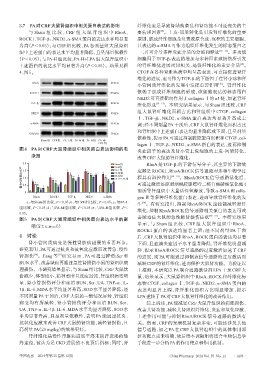
3.7 PA对CRF大鼠肾组织中相关蛋白表达的影响 纤维化也是导致肾结构紊乱和肾功能不可逆丧失的主
与 Sham 组 比 较 ,CRF 组 大 鼠 肾 组 织 中 RhoA、 要病理因素 。上皮-间质转化是引发肾纤维化的重要
[9]
ROCK1、TGF-β1、NKD2、α-SMA蛋白的表达水平均显著 原因,肌成纤维细胞是负责胶原合成、沉积的主要细胞,
升高(P<0.05);与 CRF 组比较,PA 各剂量组大鼠肾组 其表达的α-SMA可作为组织纤维化发生的标志蛋白之
织中上述蛋白的表达水平均显著降低,且呈剂量依赖性 一,并可介导多种炎症介质的分泌和释放 [12―13] 。多功能
(P<0.05);与PA-H组比较,PA-H+LPA组大鼠肾组织中 细胞因子 TGF-β1表达的增加与多种因素致损伤所引发
[14]
上述蛋白的表达水平均显著升高(P<0.05)。结果见图 的肾纤维化进展密切相关,是促纤维化的重要介质 。
4、图5。 CTGF 在各种肾脏疾病中均呈高表达,可直接促进肾纤
维化的进展,也可作为TGF-β1的下游因子在肾小球和肾
RhoA 20 kDa [15]
小管间质纤维化的发展中发挥重要作用 。肾纤维化
依赖于肌成纤维细胞的形成,该细胞表达的标志蛋白
ROCK1 158 kDa
NKD2可直接靶向作用于collagen Ⅰ的α1链,加速肾纤
44 kDa
维化形成 。本研究结果显示,与 Sham 组比较,CRF
TGF-β 1 [16―17]
组大鼠肾纤维化面积占比和肾组织中 CTGF、collagen
NKD2 59 kDa
Ⅰ、TGF-β1、NKD2、α-SMA 蛋白表达均显著升高或上
α-SMA 45 kDa 调;经不同剂量PA干预后,CRF大鼠肾纤维化面积占比
和肾组织中上述蛋白表达均显著降低或下调,且呈剂量
GAPDH 36 kDa
依赖性,提示PA可通过抑制胶原蛋白沉积和CTGF、col‐
Sham组 CRF组 PA-L组 PA-M组 PA-H组 PA-H+
LPA组 lagen Ⅰ、TGF-β1、NKD2、α-SMA 蛋白的表达,进而抑制
图4 PA 对 CRF 大鼠肾组织中相关蛋白表达影响的电
炎症因子的表达及肾小管上皮细胞的上皮-间质转化,
泳图 改善CRF大鼠的肾纤维化。
2.0 Sham组 RhoA 是 TGF-β1的下游信号分子,其主要的下游效
CRF组
蛋白相对表达水平 1.5 PA-M组 应器是ROCK1,RhoA/ROCK信号通路对多种生物学过
PA-L组
[18―19]
PA-H组
程具有调控作用
。RhoA/ROCK 信号通路活化后,
1.0
PA-H+LPA组
可通过激活还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4
0.5
0 而诱导肾组织中大量活性氧释放,导致 α-SMA 和 colla‐
RhoA ROCK1 TGF-β 1 NKD2 α-SMA gen Ⅳ等多种纤维化蛋白表达,进而导致肾纤维化的发
a:与Sham组比较,P<0.05;b:与CRF组比较,P<0.05;c:与PA-L [20]
生 。有研究指出,抑制 RhoA/ROCK 途径能减轻肾纤
组比较,P<0.05;d:与PA-M组比较,P<0.05;e:与PA-H组比较,P< 维化,抑制 RhoA/ROCK 信号通路相关蛋白的表达可改
0.05。 [20―21]
图5 PA 对 CRF 大鼠肾组织中相关蛋白表达水平的影 善脓毒症大鼠的急性肺肾损伤症状 。本研究结果
显示,与 Sham 组比较,CRF 组大鼠肾组织中 RhoA、
响(x±s,n=5)
ROCK1 蛋白的表达均显著上调;经不同剂量 PA 干预
4 讨论 后,CRF大鼠肾组织中RhoA、ROCK蛋白的表达均显著
肾小管间质病变是慢性肾脏病进展的重要环节。 下调,且血清炎症因子水平显著降低,肾纤维化明显减
研究表明,PA可通过抗炎和抗氧化应激而改善急、慢性 轻,提示 RhoA/ROCK 信号通路的过度激活加速了 CRF
肾损伤 。Jiang 等 研究显示,PA 可通过降低 Scr 和 的进展,而 PA 可能通过抑制该信号通路的过度激活而
[11]
[10]
BUN水平,改善缺血再灌注急性肾损伤小鼠的肾组织病 减轻CRF的肾纤维化,进而保护大鼠肾功能。为验证以
理损伤。本研究结果显示,与Sham组比较,CRF大鼠饮 上推测,本研究以 PA 联合通路激活剂 LPA 干预 CRF 大
食减少,体型瘦小,精神萎靡且反应迟钝,肾组织病变明 鼠,结果显示,大鼠肾组织中 RhoA、ROCK 和纤维化标
显,肾小管损伤评分和血清 BUN、Scr、UA、TNF-α、IL- 志物 CTGF、collagen Ⅰ、TGF-β1、NKD2、α-SMA 蛋白的
1β、IL-6、MDA水平均显著升高,SOD水平显著降低;经 表达均显著上调,肾纤维化面积占比明显增加,提示
不同剂量PA干预后,CRF大鼠的一般情况好转,肾组织 LPA逆转了PA对CRF大鼠肾纤维化的改善作用。
病变均有所减轻,肾小管损伤评分和血清 BUN、Scr、 综上所述,PA能减轻CRF大鼠肾组织的病理损伤,
UA、TNF-α、IL-1β、IL-6、MDA水平均显著降低,SOD水 改善其肾功能,减轻其肾组织纤维化、炎症和氧化应激,
平均显著升高,且呈剂量依赖性,表明 PA 能通过抗炎、 上述作用可能与抑制 RhoA/ROCK 信号通路的激活有
抗氧化应激来改善 CRF 大鼠的肾功能,减轻肾损伤,且 关。然而,CRF 的发病机制复杂多变,可能还涉及其他
高剂量PA(20 mg/kg)的效果更好。 信号通路,加之 PA 在 CRF 大鼠肾组织中的具体作用部
肾纤维化是慢性肾脏病进展至终末期肾衰竭的最 位和靶点尚未明确,故后续本课题组将结合生物信息学
终途径,被认为是 CKD 进展的不良预后指标;同时,肾 手段进一步分析PA的作用靶点和作用机制。
中国药房 2024年第35卷第12期 China Pharmacy 2024 Vol. 35 No. 12 · 1493 ·