Page 61 - 《中国药房》2023年20期
P. 61
50 5 000 150
b b
b 4 000 a
在中心方格花费的总时间/s 30 a 行进的总距离/cm 3 000 a 累计不动时间/s 100 b b
40
b
20
2 000
50
10
0 1 000 0 0
空白对 PSD模 MBD/ FLX组 空白对 PSD模 MBD/ FLX组 空白对 PSD模 MBD/ FLX组
照组 型组 BDD组 照组 型组 BDD组 照组 型组 BDD组
A.在中心方格花费的总时间 B.行进的总距离 C.累计不动时间
a:与空白对照组比较,P<0.05;b:与PSD模型组比较,P<0.05。
图2 MBD/BDD对PSD模型大鼠行为学的影响(x±s,n=8)
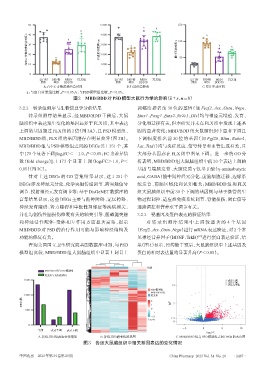
3.2.2 转录组测序与生物信息学分析结果 调幅度排名前 30 位的基因(如 Fezf2、Arx、Ostn、Nrgn、
转录组测序结果显示,经 MBD/BDD 干预后,大鼠 Emx1、Foxg1、Emx2、Nr2e1、Dlx)均与神经元增殖、发育、
脑组织中表达发生变化的基因远多于FLX组,其中表达 分化和迁移有关,但本研究并未在FLX组中发现上述基
上调的基因超过FLX组的2倍(图3A),且PSD模型组、 因的显著变化;MBD/BDD 组大鼠脑组织中显著下调且
MBD/BDD 组、FLX 组的基因谱存在明显差异(图 3B)。 下调幅度排名前 30 位的基因(如 Fgf20、Rlim、Robo4、
MBD/BDD组与PSD模型组之间的DEGs共1 351个,其 Lat、Tstd1)均与炎症反应、信号转导和血管生成有关,且
中178个显著下调[log2FC<-1.0,P<0.05;FC为差异倍 大部分基因亦在 FLX 组中明显下调。进一步的 GO 分
数(fold change)]、1 173 个显著上调(log2FC>1.0,P< 析表明,MBD/BDD组大鼠脑组织中前30个表达上调的
0.05)(图3C)。 基因与端脑发育、大脑皮质 γ 氨基丁酸(γ-aminobutyric
针对上述 DEGs 的 GO 富集结果显示,这 1 351 个 acid,GABA)能中间神经元分化、前脑细胞迁移、边缘系
DEGs涉及神经元分化、化学突触传递调节、跨突触信号 统发育、前脑区域化和认知相关;MBD/BDD 组和 FLX
调节、投射神经元发育调节等;基于DisGeNET数据库的 组大鼠脑组织中前 30 个下调的基因则与基于微管的生
富集结果显示,这些 DEGs 主要与精神障碍、记忆障碍、 物过程调控、适应性免疫系统调节、脊髓损伤、凋亡信号
神经发育障碍、智力障碍和单极性抑郁症等疾病相关, 通路调控和营养水平调节有关。
并在与创伤性脑损伤修复有关的轴突引导、胆碱能突触 3.2.3 靶基因及蛋白表达的验证结果
和神经活性配体-受体相互作用方面显著富集,提示 对 转 录 组 测 序 结 果 中 上 调 较 显 著 的 4 个 基 因
MBD/BDD 对 PSD 的治疗作用可能与影响神经结构及 (Fezf2、Arx、Ostn、Nrgn)进行mRNA表达验证,对2个常
[18]
功能的修复有关。 见神经营养因子(BDNF、TrkB) 进行蛋白表达验证,结
查询美国国立卫生研究院基因数据库可知,与PSD 果(图4)显示,经药物干预后,大鼠脑组织中上述基因及
模型组比较,MBD/BDD 组大鼠脑组织中显著上调且上 蛋白的相对表达量均显著升高(P<0.05)。
组别
MBD/BDD组与PSD模型组
FLX组与PSD模型组
1 500 表达上调
表达下调
14 表达无变化
PSD模型组
MBD/BDD组
1 000 FLX组
DEGs数 2 1 lgP 7
500 0
-1
-2
Z score 1.3
0
0
-5 0 5 10
全部 表达下调 表达上调
log 2 FC
A.各组基因组表达变化情况 B.各组基因谱变化的热图 C. MBD/BDD组与PSD模型组之间DEGs的火山图
图3 各组大鼠脑组织中相关基因表达的变化情况
中国药房 2023年第34卷第20期 China Pharmacy 2023 Vol. 34 No. 20 · 2487 ·