Page 26 - 《中国药房》2023年16期
P. 26
lba1
DAPI
叠加
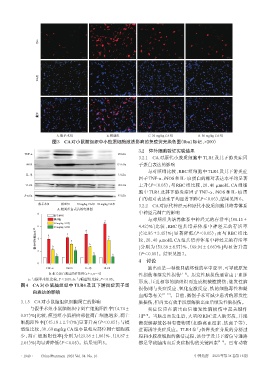
A.假手术组 B.模型组 C. 30 mg/kg CA组 D. 60 mg/kg CA组
图3 CA对小鼠脑组织中小胶质细胞激活影响的免疫荧光染色图(Iba1标记,×200)
3.2 体外细胞验证实验结果
TNF-α 26 kDa
3.2.1 CA 对原代小胶质细胞中 TLR4 及其下游炎症因
iNOS 131 kDa 子蛋白表达的影响
与对照组比较,RBC 组细胞中 TLR4 及其下游炎症
IL-1β 31 kDa
因子TNF-α、iNOS和IL-1β蛋白的相对表达水平均显著
TLR4 90 kDa 上升(P<0.05);与 RBC 组比较,20、40 μmol/L CA 组细
胞中 TLR4 及其下游炎症因子 TNF-α、iNOS 和 IL-1β 蛋
β-actin 42 kDa
白的相对表达水平均显著下降(P<0.05),结果见图6。
假手术组 模型组 30 mg/kg CA组 60 mg/kg CA组 3.2.2 CA对原代神经元和原代小胶质细胞共培养体系
A.相关蛋白表达的电泳图
8 中神经元凋亡的影响
假手术组
模型组 与对照组共培养体系中神经元的存活率[(88.15±
a
30 mg/kg CA组 a 4.42)%]比较,RBC 组共培养体系中神经元的存活率
蛋白相对表达水平 6 4 a a b b [ (32.85±3.45)%]显著降低(P<0.05);而与 RBC 组比
60 mg/kg CA组
较,20、40 μmol/L CA 组共培养体系中神经元的存活率
2 b b b [分别为(53.38±4.57)%、(69.94±4.66)%]均显著升高
b b b (P<0.05)。结果见图7。
4 讨论
0
TNF-α iNOS IL-1β TLR4 脑出血是一种极具破坏性的卒中亚型,可导致原发
B.相关蛋白表达的柱形图(x±s,n=4) 性损伤和继发性损伤 [1―2] 。原发性脑损伤通常由于血肿
a:与假手术组比较,P<0.05;b:与模型组比较,P<0.05。 形成、压迫相邻的脑组织而造成机械性损伤;继发性脑
图4 CA 对小鼠脑组织中 TLR4 及其下游炎症因子蛋
损伤则与炎症反应、氧化应激反应、铁的细胞毒性和凝
白表达的影响
血酶等有关 [11―12] 。目前,微创手术可减少患者的原发性
3.1.5 CA对小鼠脑组织细胞凋亡的影响 脑损伤,但尚无有效手段缓解脑出血后继发性脑损伤。
与假手术组小鼠脑组织中凋亡细胞阳性率[(4.74± 炎症反应在脑出血后继发性脑损伤中起关键作
0.57)%]比较,模型组小鼠相应部位凋亡细胞增多,凋亡 用 [2,4] 。当脑出血发生后,大量的RBC进入脑实质,并逐
细胞阳性率[(45.18±2.74)%]显著升高(P<0.05);与模 渐裂解释放各种有毒物质(如游离血红素、铁离子等),
型组比较,30、60 mg/kg CA组小鼠相应部位凋亡细胞减 进而诱导炎症反应。TLR4参与各种炎症介质的分泌过
少,凋亡细胞阳性率[分别为(23.38±1.86)%、(10.87± 程和小胶质细胞的激活过程,该分子及其下游信号通路
2.04)%]均显著降低(P<0.05)。结果见图5。 都是导致脑出血后炎症损伤的关键因素 [5―6] 。已有动物
· 1940 · China Pharmacy 2023 Vol. 34 No. 16 中国药房 2023年第34卷第16期