Page 37 - 《中国药房》2023年4期
P. 37
取血后处死,取右侧胫骨,剔除肌肉,用生理盐水冲洗干 least squares-discriminant analysis,OPLS-DA),以变量投
净,以保鲜膜和锡纸包裹后,分装在密封袋中并标记,置 影重要性(variable importance in the project,VIP)值>1
于-80 ℃保存备用。 且 P<0.05 为标准,筛选各组间差异代谢物。同时借助
2.4 血清中骨代谢与氧化应激指标含量的检测 PubChem(https://pubchem.ncbi.nlm.nih.gov/)、人类代谢
采用酶联免疫吸附测定法,参照试剂盒说明书检测 组数据库(HMDB)(http://www.hmdb.ca/)以及化学标准
血 清 中 骨 代 谢 指 标(HYP、ALP)及 氧 化 应 激 指 标 品对上述差异代谢物进行结构鉴定。最终采用Metabo‐
(TAOC、SOD、MDA)的含量。 Analyst(http://www.metaboanalyst.ca/)进行生物代谢通
2.5 骨微结构的检测 路分析。基于通路富集分析和通路拓扑分析,以-lg(P)
采 用 PET/CT 扫 描 各 组 大 鼠 右 侧 胫 骨 ,并 使 用 值>2 和通路影响阈值>0.05 为标准,确定蓝刺头主要
micro-CT骨分析软件进行分析,评价各组大鼠右侧胫骨 影响的代谢通路。
密度(bone mineral density,BMD)、骨小梁厚度(trabecu‐ 2.7 统计学分析
lar thickness,Tb·Th)、骨小梁数量(trabecular number, 采用 SPSS 19.0 软件对组间的差异进行统计学分
Tb·N)、骨小梁间距(trabecular separation,Tb·Sp)。同 析,多组间比较采用单因素方差分析,组间两两比较采
时在感兴趣区域图像中测量胫骨中轴处皮质骨的骨体 用Bonferroni法。检验水准α=0.05。
积分数(bone volume fraction,BVF)、骨表面积/骨体积比 3 结果
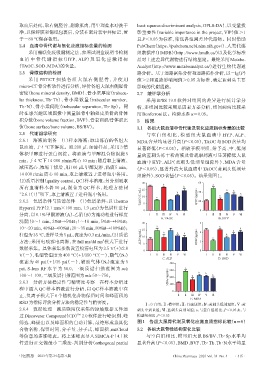
值(bone surface/bone volume,BS/BV)。 3.1 各组大鼠血清中骨代谢及氧化应激指标含量的比较
2.6 代谢组学研究 与空白组相比,模型组大鼠血清中 HYP、ALP、
2.6.1 溶液的制备 (1)样本溶液:取出冻存的各组大 MDA 含量均显著升高(P<0.05),TAOC 与 SOD 含量均
鼠血清,于 4 ℃下解冻。取 200 µL 血清样品,采用 3 倍 显著降低(P<0.05)。相较于模型组,给予高、中、低剂
体积甲醇进行蛋白沉淀。将血清与甲醇混合物涡旋 5 量的蓝刺头冻干粉药液及骨疏康药液可显著降低大鼠
min,于 4 ℃下 14 000 r/min 离心 10 min;随后取上清液, 血清中 HYP、ALP(蓝刺头低剂量组除外)、MDA 含量
减压离心、浓缩干燥后,用100 µL甲醇复溶,涡旋5 min, (P<0.05),显著升高大鼠血清中 TAOC(蓝刺头低剂量
14 000 r/min 离心 10 min,取上清液置于进样瓶中备用。 组除外)、SOD含量(P<0.05)。结果见图1。
(2)质量控制(quality control,QC)样本溶液:另分别吸取
20 b 60 a
所有血清样本各 10 μL 混合为 QC 样本,处理方法同 15 b b
“2.6.1(1)”项下,取上清液置于进样瓶中备用。 ( U/mL ) 10 a b ( ng/mL ) 40 b b b
2.6.2 色谱条件与质谱条件 (1)色谱条件:以 Thermo TAOC/ 5 HYP/ 20
Hypersil PFP(2.1 mm×100 mm,1.9 μm)为色谱柱进行
0 0
分离,以0.1%甲酸溶液(A)-乙腈(B)为流动相进行梯度 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ
A. TAOC B. HYP
洗脱(0~1 min,2%B→5%B;1~10 min,5%B→46%B; 20 3
a b
10~20 min,46%B→80%B;20~35 min,80%B→100%B); 15 b b
柱温为35 ℃,进样量为5 µL,流速为0.3 mL/min。(2)质谱 ( ng/mL ) 10 b b b ( ng/mL ) 2 a b
方法:采用电喷雾电离源,在 full ms/dd ms 模式下进行 ALP/ 5 SOD/ 1
2
数据采集。具体采集参数设置喷雾电压为3.5 V(+)/2.8
0 0
V(-),毛细管温度为400 °C(+)/350 °C(-),鞘气(N2 ) Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ
C. ALP D. SOD
流速为 40 psi(+)/35 psi(-),辅助气体(N2 )流速为 5 400
psi,S-lens RF 水平为 50.0,一级质谱扫描范围为 m/z 300 a
100~1 100,二级质谱扫描范围为m/z 50~750。 ( ng/mL ) 200 b b b b
2.6.3 分析方法稳定性与精密度考察 在样本分析过 MDA/ 100
程中插入 QC 样本溶液进行分析,以 QC 样本溶液中在
0
正、负离子模式下6个随机化合物保留时间和峰面积的 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ
E. MDA
RSD为指标评价分析方法的稳定性与精密度。 Ⅰ:空白组;Ⅱ:模型组;Ⅲ:骨疏康组;Ⅳ:蓝刺头低剂量组;Ⅴ:蓝
2.6.4 数据处理 液质联用仪采集的原始数据文件通 刺头中剂量组;Ⅵ:蓝刺头高剂量组;a:与空白组相比,P<0.05;b:与
过 Discoverer Compound(CD) 2.0 软件进行峰识别、峰 模型组相比,P<0.05
TM
筛选、峰提出以及峰面积的自动计算,最终形成兼具化 图1 各组大鼠骨代谢及氧化应激血清指标比较(n=6)
合物名称、保留时间、分子量、分子式、峰面积、mzCloud 3.2 各组大鼠骨微结构变化比较
等信息的多维峰表。将上述峰表导入 SIMCA-P 14.1 软 与空白组相比,模型组大鼠 BS/BV、Tb·Sp 水平均
件进行正交偏最小二乘法-判别分析(orthogonal partial 显著升高(P<0.05),BMD、BVF、Tb·Th、Tb·N水平均显
中国药房 2023年第34卷第4期 China Pharmacy 2023 Vol. 34 No. 4 · 415 ·