Page 32 - 《中国药房》2022年20期
P. 32
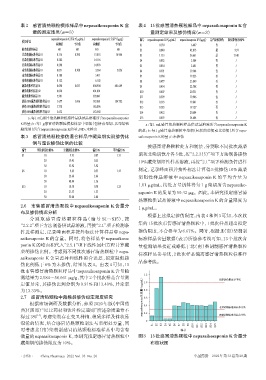
表2 感冒清热颗粒模拟样品中nepasaikosaponin K 含 表4 15批感冒清热颗粒样品中nepasaikosaponin K含
量的测定结果(n=3) 量测定结果及掺伪情况(n=3)
a
nepasaikosaponin K含量 /(μg/mL) nepasaikosaponin K含量 /(μg/g) 编号 nepasaikosaponin K /(μg/mL) nepasaikosaponin K /(μg/g) 是否疑似掺伪 疑似掺伪比例/%
b
a
b
模拟样品
检测值 平均值 检测值 平均值 S1 0.130 6.487 否 /
缺柴胡阴性样品 ND ND ND ND S2 0.840 42.013 是 9.91
北柴胡制标准样品01 0.316 0.298 15.818 14.946 S3 1.133 56.661 是 13.40
北柴胡制标准样品02 0.282 14.116 S4 0.052 2.584 否 /
北柴胡制标准样品03 0.298 14.903 S5 0.054 2.681 否 /
南柴胡制标准样品01 0.071 0.100 3.564 5.026 S6 0.391 19.544 否 /
南柴胡制标准样品02 0.108 5.411 S7 0.384 19.223 否 /
南柴胡制标准样品03 0.122 6.102 S8 0.477 23.849 否 /
藏柴胡阳性样品01 8.098 8.033 404.904 401.649 S9 0.454 22.708 否 /
藏柴胡阳性样品02 8.020 401.001 S10 0.407 20.331 否 /
藏柴胡阳性样品03 7.981 399.041 S11 0.399 19.946 否 /
掺伪50%藏柴胡阳性样品01 3.677 3.696 183.861 184.782 S12 0.393 19.641 否 /
掺伪50%藏柴胡阳性样品02 3.738 186.896 S13 0.383 19.127 否 /
掺伪50%藏柴胡阳性样品03 3.672 183.588 S14 0.412 20.604 否 /
a:每1 mL感冒清热颗粒模拟样品供试品溶液所含nepasaikosaponin S15 0.492 24.604 否 /
K的量;b:每1 g感冒清热颗粒模拟样品中柴胡(包括南柴胡、北柴胡和 a:每1 mL感冒清热颗粒样品供试品溶液所含nepasaikosaponin K
藏柴胡)所含nepasaikosaponin K的量;ND:未检出 的量;b:每1 g感冒清热颗粒中柴胡(包括南柴胡或北柴胡)所含nepa-
表3 感冒清热颗粒掺伪混合样品中藏柴胡实测掺伪比 saikosaponin K的量;/:未掺伪
例与理论掺伪比例的比较
按感冒清热颗粒处方和制法,分别取不同批次藏柴
编号 理论掺伪比例/% 实测掺伪比例/% 偏差/% 平均偏差/%
S1 10 9.93 0.07 1.51 胡和北柴胡饮片各5批,按“2.2.3(5)”项下方法制备掺伪
20 19.45 0.55 10%藏柴胡阳性样品溶液,再按“2.1”项下检测条件进样
50 53.92 3.92
S6 10 9.63 0.37 1.53 测定,记录峰面积并按外标法计算得5批掺伪10%藏柴
20 22.66 2.66 胡阳性样品溶液中 nepasaikosaponin K 的平均含量为
50 48.44 1.56
S15 10 10.30 0.30 1.25 1.01 μg/mL,按处方量折算得每 1 g 柴胡所含 nepasaiko‐
20 21.37 1.37 saponin K的质量为50.42 μg。因此,本研究拟定感冒清
50 52.08 2.08
热颗粒供试品溶液中 nepasaikosaponin K 的含量限度为
2.6 市售感冒清热颗粒中 nepasaikosaponin K 含量分 1 μg/mL。
布及掺伪情况分析
根据上述拟定掺伪限度,由表4和图3可知,本次收
分 别 取 感 冒 清 热 颗 粒 样 品(编 号 S1~S15),按
集的15批次市售感冒清热颗粒中,1批次样品超出拟定
“2.2.2”项下方法制备供试品溶液,再按“2.1”项下检测条
件进样测定,记录峰面积并按外标法计算样品中 nepa- 掺伪限度,不合格率为6.67%。同时,根据北(南)柴胡制
saikosaponin K 的含量。同时,将各样品中 nepasaikosa‐ 标准样品含量数据(表2)所绘参考线可知,13个批次含
ponin K的峰面积代入“2.5.1”项下线性回归方程计算藏 量检测结果接近或略低于北(南)柴胡制感冒清热颗粒
柴胡掺伪比例。考虑到不同批次感冒清热颗粒中nepa- 标准样品参考线,2 批次样品偏离感冒清热颗粒标准样
saikosaponin K 含量差异和线性拟合误差,拟定疑似掺
品参考线。
伪比例低于 6% 为未掺伪,结果见表 4。由表 4 可知,15
批市售感冒清热颗粒样品中 nepasaikosaponin K 含量检
1.2
测结果为2.584~56.661 μg/g,其中2个批次样品含量测 拟定掺伪限度参考线
定值异常,其掺伪比例分别为 9.91% 和 13.40%,异常率 ( μg/mL ) 1.0
为13.33%。 0.8
2.7 感冒清热颗粒中藏柴胡掺伪拟定限度研究 0.6
根据市场调研及数据分析,参照 2020 年版《中国药 nepasaikosaponin K含量/ 0.4
典》(四部)“0212药材和饮片检定通则”所述杂质通常不 0.2 北柴胡制标准样品参考线
[14]
得过3% ,考虑柴胡存在交叉种植、种质多样及性状易 南柴胡制标准样品参考线
0
混淆的情况,结合感冒清热颗粒制法与柴胡处方量,同 S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 S13 S14 S15
时考虑北(南)柴胡制感冒清热颗粒标准样品中均含有 编号
微量的nepasaikosaponin K,本研究拟定感冒清热颗粒中 图3 15批感冒清热颗粒中nepasaikosaponin K含量分
藏柴胡的掺伪限度为10%。 布柱状图
·2458· China Pharmacy 2022 Vol. 33 No. 20 中国药房 2022年第33卷第20期