Page 59 - 《中国药房》2022年19期
P. 59
表4 各组 HepG2 细胞中 SREBP-1c、FAS mRNA 表达
水平的检测结果(x±s,n==3)
组别 SREBP-1c mRNA FAS mRNA
对照组 1.28±0.25 0.89±0.20
模型组 6.15±0.75 a 3.74±0.10 a
GI低浓度组 4.41±0.14 b 1.76±0.21 c
GI中浓度组 3.25±0.10 c 1.39±0.09 c
GI高浓度组 1.64±0.47 c 1.35±0.10 c
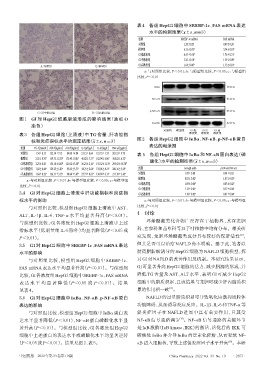
A.对照组 B.模型组
a:与对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组
比较,P<0.01
IκBα 38 kDa
NF-κB 65 kDa
p-NF-κB 65 kDa
C. GI中浓度组 D. GI高浓度组
图1 GI 对 HepG2 细胞脂滴形成的影响结果(油红 O
β-actin 42 kDa
染色)
对照组 模型组 GI低 GI中 GI高
表3 各组 HepG2 细胞(上清液)中 TG 含量、肝功能指 浓度组 浓度组 浓度组
图2 各组 HepG2 细胞中 IκBα、NF-κB、p-NF-κB 蛋白
标和炎症指标水平的测定结果(x±s,n==3)
表达的电泳图
组别 TG /(mmol/L) AST/(mg/mL) ALT/(mg/mL) IL-1β/(ng/L) IL-6/(mg/L) TNF-α/(pg/mL)
对照组 1.54±0.35 123.34±7.12 84.00±4.84 21.12±0.64 123.35±1.55 201.23±9.78 表 5 各组 HepG2 细胞中 IκBα 和 NF-κB 蛋白表达(磷
a
a
a
模型组 2.55±0.30 a 159.75±2.30 135.40±0.01 46.82±3.33 162.04±6.06 a 368.62±6.72 a 酸化)水平的检测结果(x±s,n==3)
c
b
b
GI低浓度组 2.23±0.43 136.10±4.60 121.02±3.58 36.23±2.16 155.52±11.39 295.43±18.78 b
GI中浓度组 1.82±0.44 c 129.23±5.89 c 93.82±3.71 34.75±2.64 133.06±4.21 c 246.16±3.69 c 组别 IκBα/β-actin p-NF-κB/ NF-κB
c
c
c
GI高浓度组 1.64±0.22 c 126.31±3.35 c 90.84±3.87 27.71±0.65 130.74±6.31 c 211.38±5.42 c 对照组 1.07±0.08 0.94±0.03
c
模型组 0.83±0.02 a 1.07±0.02 a
a:与对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组
GI低浓度组 1.09±0.06 b 0.83±0.02 c
比较,P<0.01
GI中浓度组 1.15±0.05 c 0.77±0.04 c
3.4 GI 对 HepG2 细胞上清液中肝功能指标和炎症指 GI高浓度组 1.18±0.02 c 0.81±0.04 c
标水平的影响 a:与对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组
与对照组比较,模型组 HepG2 细胞上清液中 AST、 比较,P<0.01
4 讨论
ALT、IL-1β、IL-6、TNF-α 水平均显著升高(P<0.01)。
与模型组比较,GI 各浓度组 HepG2 细胞上清液中上述 环烯醚萜类化合物广泛存在于植物界,其在龙胆
指标水平(低剂量组 IL-6 除外)均显著降低(P<0.05 或 科、玄参科和茜草科等双子叶植物中均有分布。相关研
[13]
P<0.01)。 究发现,龙胆环烯醚萜类成分具有较好的保肝活性 ,
3.5 GI 对 HepG2 细胞中 SREBP-1c、FAS mRNA 表达 但其是否可以治疗 NAFLD 尚不明确。基于此,笔者以
水平的影响 游离脂肪酸诱导的 HepG2 细胞为 NAFLD 细胞模型,探
与对照组比较,模型组 HepG2 细胞中 SREBP-1c、 讨GI对NAFLD的改善作用及机制。本研究结果显示,
FAS mRNA 表达水平均显著升高(P<0.01)。与模型组 GI可显著升高HepG2细胞的活力,减少脂滴的形成,并
比较,GI各浓度组HepG2细胞中SREBP-1c、FAS mRNA 降低 TG 含量及 AST、ALT 水平,表明 GI 可减少 HepG2
表 达 水 平 均 显 著 降 低(P<0.05 或 P<0.01)。 结 果 细胞中的脂质积累,且该结果与龙胆可减少肝内脂质积
[14]
见表4。 累的作用相一致 。
3.6 GI 对 HepG2 细胞中 IκBα、NF-κB、p-NF-κB 蛋白 NAFLD的过量脂质积累可导致氧化应激和线粒体
表达的影响 功能障碍,从而诱导炎症反应。IL-1β、IL-6和TNF-α等
与对照组比较,模型组 HepG2 细胞中 IκBα 蛋白表 促炎症因子在 NAFLD 进展中具有重要作用,且其受
[15]
达水平显著降低(P<0.01),NF-κB 蛋白磷酸化水平显 NF-κB 信号通路调节 。NF-κB 信号通路的关键环节
著升高(P<0.01)。与模型组比较,GI 各浓度组 HepG2 是 IκB 激酶(IκB kinase,IKK)的激活,活化后的 IKK 可
细胞中上述蛋白的表达水平或磷酸化水平均显著逆转 磷酸化 IκBα 并介导 IκBα 的泛素化降解,从而释放 NF-
[16]
(P<0.05或P<0.01)。结果见图2、表5。 κB 进入细胞核,导致上述促炎症因子水平升高 。本研
中国药房 2022年第33卷第19期 China Pharmacy 2022 Vol. 33 No. 19 ·2357·