Page 17 - 《中国药房》2022年19期
P. 17
electronic medical record data,and describes the data analysis methods and key points involved in carrying out multi-center
retrospective real-world research using electronic medical record data,taking the post marketing safety research of drugs as an
example. Finally,the full process operation procedure applicable to the use of multi-center retrospective electronic medical record
data is established.
KEYWORDS real-world data;electronic medical record data;retrospective research;data curation;multi-center research;
operation procedure
真实世界数据来源于患者个人诊疗记录等多种途
真实世界研 确定数据提
径,已成为上市后药品安全性监测和评价的重要数据来 究设计 取规则
源。区别于基于研究目的主动收集的健康医疗数据,来 源数据适用
性评价 不通过
源于常规工作中收集的医疗卫生数据虽然具有数据量
大、人群覆盖广等优势,但也存在数据缺失、标准化程度 数据提取及
验证
[1]
不佳等局限 。要将真实世界数据转化为真实世界证据 不通过
通过
以支持临床决策,需要围绕具体研究问题或目的,构建 样本数据 样本数据 全样本数据
提取 验证 提取 全样本数据
验证
研究型数据处理体系,采用合适的研究设计和统计学方
[2]
法回答设定好的问题 。在将真实世界证据用于为相关 通过
领域提供证据的过程中,需要从数据的完整性、一致性、 全流程:
数据合库 质量控制、
合理性等多角度考虑,从而设计完善的真实世界数据使 数据管理与
储存
不通过
用操作规范。 数据核查
2021年4月,国家药品监督管理局药品审评中心发 数据完整性 数据准确性
核查 核查
布的《用于产生真实世界证据的真实世界数据指导原则
通过
(试行)》对真实世界数据的来源、评价、治理、标准、安全
合规、质量保障、适用性等方面给出了具体的要求和建 数据清洗
[3]
议 。2022 年 7 月,国家药品监督管理局药品审评中心
数据转化
发布的《药物真实世界研究设计与方案框架指导原则
诊断相关字 药品相关字 检验检查指
(征求意见稿)》,对药物研发中真实世界研究的设计及 段转化 段转化 标转化
方案制定提出了更有针对性的技术要求 。我国流行病 其他变量 衍生变量
[4]
计算
转化
学与卫生统计学专家组织翻译的《使用常规收集医疗卫
生数据开展观察性研究的报告规范》规范了真实世界研 数据分析
究报告的内容清单,并列举了实例以辅助理解 [5―6] 。中
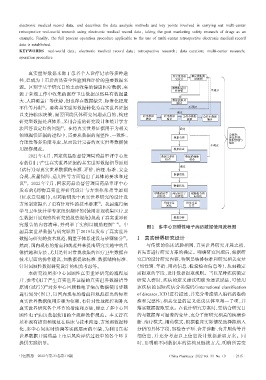
图1 多中心回顾性电子病历数据使用流程图
国真实世界数据与研究联盟于 2019 年发布了真实世界
[7]
数据与研究的技术规范,侧重于体系建设与步骤细分 。 1 真实世界研究设计
然而,国内现有的指南和规范并未提出研究实施中的具 与传统的临床试验相同,真实世界研究开展之初,
体措施和方法,尤其是针对常规收集的医疗卫生数据在 首先要进行研究方案的确定。明确研究问题后,根据研
技术层面的操作建议,如数据提取标准、数据结构标准、 究目的设计研究内容,特别是纳排标准和研究相关变量
针对回顾性数据研究设计的相关考虑等。 (如性别、年龄、用药信息、检验检查信息等),从而确定
本研究按照多中心回顾性真实世界研究的流程展 需提取的字段,设计数据提取规则。当以某种疾病确定
开,参考《用于产生真实世界证据的真实世界数据指导 研究人群时,疾病的定义建议明确为通识说法,可使用
[3]
原则(试行)》 对多中心回顾性电子病历数据使用步骤 该疾病的国际疾病分类编码(international classification
进行划分(图 1),以国内现有的指南和规范提出的标准 of diseases,ICD)进行描述,并充分考虑纳入编码的准确
真实世界数据使用步骤为框架,有针对性地把控和补充 性和完整性;相关变量的定义建议具体至每一子项,并
真实世界研究各个环节的措施和方法,建立了多中心回 落实数据提取要求。在设计研究方案时,要结合研究目
顾性电子病历数据使用的全流程操作规范。本文旨在 的与数据库可涵盖的变量,充分了解研究相关的疾病诊
填补现有指南和规范在临床与技术沟通、方案和数据转 断、治疗模式、用药模式,根据临床实际情况选择拟纳入
化、多中心间实时协调等实践层面的空缺,为利用真实 分析的具体字段,如检查子项、合并诊断、合并用药等详
世界数据开展药品上市后风险评估过程中的各个环节 细信息,并充分考虑以上信息设计数据提取方案。同
提供实践指导。 时,要明确不同数据库的结构及链接方式,明确所需变
中国药房 2022年第33卷第19期 China Pharmacy 2022 Vol. 33 No. 19 ·2315·