Page 70 - 《中国药房》2022年14期
P. 70
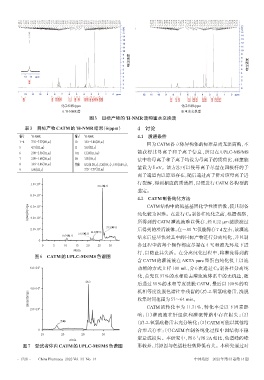
响应强度 响应强度
化学位移/ppm 化学位移/ppm
A. H-NMR谱 B.重水交换谱
1
图5 目标产物的 H-NMR谱和重水交换谱
1
表3 目标产物CATM的 H-NMR结果(δ/ppm) 4 讨论
1
编号 1 H-NMR 编号 1 H-NMR 4.1 质谱条件
1~4 7.35~7.57(4H,m) 10 3.81~3.86(2H,m) 因为CATM各立体异构体的标准品尚无法商购,不
5 4.71(1H,m) 11 3.63(3H,s)
6 2.90~2.56(2H,m) OH 12.24(1H,brs) 能获得其母离子和子离子信息,所以在 UPLC-MS/MS
7 2.09~1.68(2H,m) SH 3.05(1H,s) 法中将母离子和子离子均设为母离子的质荷比,碰撞能
8 3.81~3.86(1H,m) 其他 8.32(0.2H,s)、5.20(1H,s)、1.91(0.4H,s)、
9 5.90(1H,s) 7.35~7.57(1H,m) 量设为 5 eV。该方法可以使母离子尽量在四极杆的子
离子通道内以原型存在,随后通过离子阱对该母离子进
1.0×10 5 行裂解,得到相应的质谱图,以便进行 CATM 各构型的
26.5(峰4)
鉴定。
8.0×10 4
4.2 CATM制备纯化方法
CATM结构中的巯基基团化学性质活泼,使其制备
intensity/cps 6.0×10 4 纯化较为困难。在进行C18制备柱纯化之前,根据观察,
4
4.0×10
所得到的 CATM 灌流液难以保存,经 0.22 μm 滤膜滤过
27.3(峰5)
2.0×10 4 后得到的澄清液体,在-80 ℃仅能保存7 d左右,故灌流
22.3(峰3)
21.3(峰2)
10.7(峰1) 结束后应尽快对其中的目标产物进行分离纯化,并且制
0
0 5 10 15 20 25 30 备过程中的每个操作都应尽量在 4 ℃和避光环境下进
t/min
行,以防止其失活。在分离纯化过程中,将灌流得到的
图6 CATM的UPLC-MS/MS色谱图
含 CATM 的灌流液在 AKTA pure 型蛋白纯化仪上以流
6.0×10 4 动相的方式上样 100 mL,分 6 次通过 C18制备柱分离纯
化,首先以 97%的水相除去灌流液体系中的无机盐,随
26.3
后通过 55%的水相等度洗脱 CATM,最后以 100%的有
4.0×10 4 机相等度洗脱色谱柱中残留的(S)-2-氧氯吡格雷,洗脱
intensity/cps 收集时间范围为57~64 min。
2.0×10 4 CATM 的转化率为 11.71%,转化率受以下因素影
响:(1)灌流液在肝组织和灌流管路中存在损失;(2)
杂峰 (S)-2-氧氯吡格雷未充分转化;(3)CATM可能以其他结
0 合形式存在;(4)CATM 在制备纯化过程中因结构不稳
15 20 25 30
t/min 定造成损失。本研究中,图 6 与图 2A 相比,色谱峰的峰
图7 受试者体内CATM的UPLC-MS/MS色谱图 形较差,其原因与色谱柱柱效降低有关。本研究通过对
·1728 · China Pharmacy 2022 Vol. 33 No. 14 中国药房 2022年第33卷第14期