Page 65 - 《中国药房》2021年24期
P. 65
2.4 细胞凋亡率的检测 标蛋白的表达量。实验重复3次。
采用流式细胞术进行检测。取对数生长期的HK-2 2.7 统计学方法
细胞,用0.25%胰蛋白酶消化后,收集细胞,用DMEM完 采用SPSS 21.0软件对数据进行统计分析。数据均
5
全培养基重悬制成单细胞悬液,以 5×10 个/孔接种于 6 以 x±s 表示,多组间比较采用单因素方差分析,组间两
孔板中,按“2.2”项下方法分组、造模、给药、培养,每组设 两比较采用LSD-t检验。检验水准α=0.05。
3 个复孔。培养结束后,收集各组细胞分别置于 15 mL 3 结果
6
离心管(细胞密度≥1×10 个/管)中,以 1 500 r/min 离心 3.1 萝卜硫素对高糖诱导HK-2细胞存活率的影响
5 min,收集细胞沉淀;用 1×D-Hanks 液重悬和洗涤细胞 与正常组比较,高糖组细胞的存活率显著降低(P<
2 次,再用 binding buffer 重悬,使细胞密度达到 1×10 6 0.05)。与高糖组比较,萝卜硫素低、中、高浓度组和厄贝
个/mL,每管加入 Annexin Ⅴ-FITC 试剂 5 µL,室温避光 沙坦组细胞的存活率均显著升高(P<0.05)。与萝卜硫
孵育 10 min;加入 PI 试剂 5 µL,室温避光孵育 5 min;再 素低浓度组比较,萝卜硫素中、高浓度组细胞的存活率
加入 PBS 至 500 µL,轻轻混匀,使用流式细胞仪检测细 均显著升高(P<0.05)。与厄贝沙坦组比较,萝卜硫素
胞凋亡情况,计算细胞凋亡率:细胞凋亡率(%)=细胞 高浓度组细胞的存活率差异无统计学意义(P>0.05)。
早期凋亡率+细胞晚期凋亡率+坏死细胞率。实验重复 结果见图1。
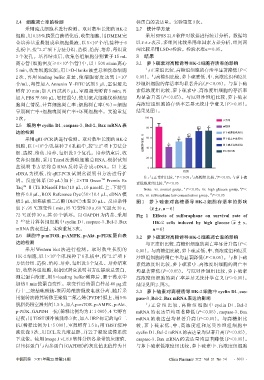
3 次。 100 正常组
2.5 细胞中 cyclin D1、caspase-3、Bcl-2、Bax mRNA 表 #
80 #□ 高糖组
达的检测 萝卜硫素低浓度组
% #□
采用qRT-PCR法进行检测。取对数生长期的HK-2 60 # 萝卜硫素中浓度组
细胞,以1×10 个/孔接种于6孔板中,按“2.2”项下方法分 细胞存活率, 40 * 萝卜硫素高浓度组
6
组、造模、给药、培养,每组设3个复孔。培养结束后,收 厄贝沙坦组
集各组细胞,采用 Trizol 法提取细胞总 RNA,根据试剂 20
盒说明书方法将总 RNA 反转录合成 cDNA。以上述 0
cDNA 为模板,按 qRT-PCR 试剂盒说明书方法进行扩 组别
#
注:与正常组比较,P<0.05;与高糖组比较,P<0.05;与萝卜硫
*
增。反应体系(20 µL)如下:2×TB Green TM Premix Ex
□
素低浓度组比较,P<0.05
Taq TM Ⅱ(Tli RNaseH Plus)10 µL,10 µmol/L 上、下游引
Note:vs. normal group, P<0.05;vs. high glucose group,P<
*
#
物各 0.8 µL,ROX Reference Dye(50×)0.4 µL,cDNA 模 0.05;vs. sulforaphane low concentration group, P<0.05
□
板2 µL,加焦碳酸二乙酯(DEPC)水至20 µL。反应条件 图 1 萝卜硫素对高糖诱导 HK-2 细胞存活率的影响
如下:95 ℃预变性1 min;95 ℃变性30 s,60 ℃退火30 s, (x±±s,n=6)
72 ℃延伸 30 s,共 40 个循环。以 GAPDH 为内参,采用 Fig 1 Effects of sulforaphane on survival rate of
2 -ΔCt 法计算各组细胞中 cyclin D1、caspase-3、Bcl-2、Bax HK-2 cells induced by high glucose(x ±± s,
mRNA的表达量。实验重复3次。 n=6)
2.6 细胞中 p-mTOR、p-AMPK、p-Akt、p-PI3K 蛋白表 3.2 萝卜硫素对高糖诱导HK-2细胞凋亡率的影响
达的检测 与正常组比较,高糖组细胞的凋亡率显著升高(P<
采用 Western blot 法进行检测。取对数生长期的 0.05)。与高糖组比较,萝卜硫素低、中、高浓度组和厄贝
6
HK-2 细胞,以 1×10 个/孔接种于 6 孔板中,按“2.2”项下 沙坦组细胞的凋亡率均显著降低(P<0.05)。与萝卜硫
方法分组、造模、给药、培养,每组设3个复孔。培养结束 素低浓度组比较,萝卜硫素中、高浓度组细胞的凋亡率
后,收集各组细胞,根据试剂盒说明书方法提取总蛋白, 均显著降低(P<0.05)。与厄贝沙坦组比较,萝卜硫素
测定蛋白浓度,用 5×loading buffer 稀释后,置于沸水中 高浓度组细胞的凋亡率差异无统计学意义(P>0.05)。
加热 5 min 使蛋白变性。取变性后的蛋白样品 40 μg 进 结果见图2、图3。
行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,随后采 3.3 萝卜硫素对高糖诱导 HK-2 细胞中 cyclin D1、cas-
用湿转法将其转移至聚偏二氟乙烯(PVDF)膜上,用5% pase-3、Bcl-2、Bax mRNA表达的影响
脱脂奶粉室温封闭1.5 h,加入p-mTOR、p-AMPK、p-Akt、 与 正 常 组 比 较 ,高 糖 组 细 胞 中 cyclin D1、Bcl-2
p-PI3K、GAPDH一抗(稀释比例均为1∶1 000),4 ℃孵育 mRNA 的表达量均显著降低(P<0.05),caspase-3、Bax
过夜;用TBST缓冲液洗涤3次,加入HRP标记的IgG二 mRNA 的表达量均显著升高(P<0.05)。与高糖组比
抗(稀释比例为 1 ∶ 5 000),室温孵育 1.5 h;用 TBST 缓冲 较,萝卜硫素低、中、高浓度组和厄贝沙坦组细胞中
液洗涤 3 次,用 ECL 发光液显影,并置于凝胶成像系统 cyclin D1、Bcl-2 mRNA的表达量均显著升高(P<0.05),
下成像。使用Image J v1.8.0软件分析各条带的灰度值, caspase-3、Bax mRNA 的表达量均显著降低(P<0.05)。
以目标蛋白与内参蛋白(GAPDH)的灰度值比值作为目 与萝卜硫素低浓度组比较,萝卜硫素中、高浓度组细胞
中国药房 2021年第32卷第24期 China Pharmacy 2021 Vol. 32 No. 24 ·3003 ·