Page 51 - 2021年17期
P. 51
常规指标。与正常组比较,模型组小鼠血清中 WBC、 黄芪注射液组、次生成分低剂量组处理后的血清待测样
NE、LY、MO计数均显著降低(P<0.01);与模型组比较, 本及QC样本,按“2.3.2”项下色谱与质谱条件进行分析,
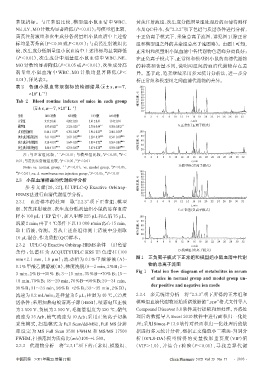
黄芪注射液组和次生成分各剂量组小鼠血清中上述指 于正负离子模式下,采集总离子流图,详见图 1(除正常
标均显著升高(P<0.05或P<0.01);与黄芪注射液组比 组和模型组之外的其余组总离子流图略)。由图1可知,
较,次生成分低剂量组小鼠血清中上述指标均显著降低 正常组和模型组小鼠血清中各代谢物色谱峰分离良好;
(P<0.01),次生成分中剂量组小鼠血清中 WBC、NE、 在正负离子模式下,正常组和模型组小鼠的血清代谢物
MO 计数均显著降低(P<0.05 或 P<0.01),次生成分高 的种类和含量不同,说明两组间的血清代谢物存在差
剂量组小鼠血清中 WBC、MO 计数均显著降低(P< 异。基于此,笔者继续采用多元统计分析法,进一步分
0.01),详见表2。 析正常组和模型组之间血清代谢物的差异。
表 2 各组小鼠血常规指标的检测结果(x±±s,n=7, 100
90
-1
9
×10 L ) % 80
70
Tab 2 Blood routine indexes of mice in each group 相对丰度, 60
50
40
(x±±s,n=7,×10 L ) 30
-1
9
20
10
分组 WBC计数 NE计数 LY计数 MO计数 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
正常组 9.71±0.46 4.88±0.50 3.41±0.41 1.14±0.14 t,min
模型组 5.97±0.82 ** 2.32±0.20 ** 2.70±0.44 ** 0.30±0.032 ** A.正常组(正离子模式)
黄芪注射液组 11.44±1.52 ## 4.70±0.42 ## 3.96±0.25 ## 2.46±0.36 ## 100
次生成分低剂量组 7.61±0.81 ##ΔΔ 3.67±0.52 ##ΔΔ 3.20±0.39 #ΔΔ 0.54±0.10 ##ΔΔ % 80
次生成分中剂量组 9.28±0.91 ##Δ 3.64±0.58 ##ΔΔ 3.89±0.72 ## 0.56±0.06 ##ΔΔ 相对丰度, 60
40
次生成分高剂量组 8.46±1.51 ##ΔΔ 4.25±0.65 ## 3.67±0.28 ## 0.59±0.09 ##ΔΔ 20
注:与正常组比较, P<0.01;与模型组比较,P<0.05,P< 0
* *
##
#
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
0.01;与黄芪注射液组比较,P<0.05,P<0.01 t,min
ΔΔ
Δ
Note:vs. normal group, * * P<0.01;vs. model group,P<0.05, B.模型组(正离子模式)
#
100
## Δ ΔΔ
P<0.01;vs. A. membranaceus injection group,P<0.05,P<0.01 90
% 80
2.3 小鼠血清样品的代谢组学分析 70
60
参考文献[20,22],以 UPLC-Q Exactive Orbitrap- 相对丰度, 50
40
30
HRMS法进行血清代谢组学分析。 20
10
2.3.1 血清样本的处理 取“2.2.3”项下正常组、模型 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
t,min
组、黄芪注射液组、次生成分低剂量组小鼠的冻存血清 C.正常组(负离子模式)
样本 100 μL 于 EP 管中,加入甲醇 225 μL 和乙腈 75 μL, 100
涡旋2 min;再于4 ℃条件下以13 000 r/min离心15 min, % 80
60
取上清液,待测。另从上述各组待测上清液中分别取 相对丰度, 40
10 μL混合,作为质控(QC)样本。 20 0
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
2.3.2 UPLC-Q Exactive Orbitrap-HRMS条件 (1)色谱 t,min
条件:色谱柱为 ACQUITYUPLC HSS T3 色谱柱(100 D.模型组(负离子模式)
mm×2.1 mm,1.8 μm);流动相为 0.1%甲酸溶液(A)- 图1 正负离子模式下正常组和模型组小鼠血清中代谢
物的总离子流图
0.1%甲酸乙腈溶液(B),梯度洗脱(0~2 min,2%B;2~
Fig 1 Total ion flow diagram of metabolites in serum
3 min,2%B→35% B;3~15 min,35%B→70%B;15~
of mice in normal group and model group un-
18 min,70%B;18~29 min,70%B→98%B;29~31 min,
der positive and negative ion mode
98%B;31~33 min,98%B→2%B;33~35 min,2%B);
流速为 0.2 mL/min;进样量为 5 μL;柱温为 40 ℃。(2)质 2.3.4 多元统计分析 将“2.3.3”项下所得的正常组和
谱条件:采用加热电喷雾离子源(HESI),喷雾电压正极 模型组血清代谢物原始质谱数据的“.raw”格式文件导入
为 3 500 V、负极为 2 500 V,毛细管温度为 320 ℃,鞘气 Compound Discover 3.0软件进行提取和预处理,再将处
流速为 35 Arb,辅气流速为 10 Arb;采用正负离子切换 理后的数据导入 Excel 2010 软件中进行面积归一化处
采集模式,扫描模式为 Full Scan/dd-MS2,Full MS 分辨 理;采用 Simca-P 13.0 软件对经面积归一化处理后的数
率设定为 MS Full Scan 3500 FWHM 和 MS/MS 17500 据进行多元统计分析,根据正交偏最小二乘法-判别分
FWHM,扫描范围为质荷比(m/z)100→1 500。 析(OPLS-DA)模型所得的变量投影重要度(VIP)值
2.3.3 代谢物分析 将“2.3.1”项下的正常组、模型组、 (VIP>1.0),并结合 t 检验(P<0.05),寻找差异代谢
中国药房 2021年第32卷第17期 China Pharmacy 2021 Vol. 32 No. 17 ·2093 ·