Page 108 - 202010
P. 108
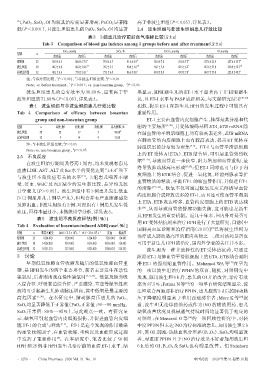
气PaO2、SaO2、OI均较其治疗前显著增高,PaCO2显著降 高于非波生坦组(P<0.05),详见表3。
低(P<0.001),且波生坦组患儿的PaO2、SaO2、OI均显著 2.4 波生坦组与非波生坦组患儿疗效比较
表3 3组患儿治疗前后血气指标比较(x±±s)
Tab 3 Comparison of blood gas indexes among 3 groups before and after treatment(x±±s)
PaO2,mmHg SaO2,% PaCO2,mmHg OI,mmHg
组别 n
治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后
对照组 25 50.9±4.5 88.8±17.4 * 79.8±6.7 91.6±4.9 * 50.4±7.8 41.0±7.5 * 157.6±23.9 257.6±35.7 *
波生坦组 50 48.7±6.0 86.8±14.6 *# 78.7±5.7 90.4±5.6 *# 50.1±7.4 42.5±6.2 * 147.6±31.0 250.9±52.7 *#
非波生坦组 32 48.1±6.6 77.8±14.1 * 77.1±6.0 86.6±8.0 * 48.8±8.8 43.9±7.0 * 148.7±33.0 223.0±49.5 *
*
#
注:与治疗前比较,P<0.001;与非波生坦组比较,P<0.05
Note:vs. before treatment, P<0.001;vs. non-bosentan group, P<0.05
#
*
波生坦组患儿的总有效率为 90.00%,显著高于非 果显示,HPH 新生儿的 ET-1 水平显著高于非 HPH 新生
波生坦组的71.88%(P<0.05),详见表4。 儿,且ET-1水平与PASP成正相关,与文献研究结果 [20,22]
表4 波生坦组与非波生坦组患儿疗效比较 相似,提示 ET-1 在新生儿 HPH 的发生过程中可能具有
Tab 4 Comparison of efficacy between bosentan 重要作用。
group and non-bosentan group ET-1主要由血管内皮细胞产生,肺部是其分泌和代
组别 n 显效,例 有效,例 无效,例 总有效率,% 谢的主要场所 [4,22] ,其受体编码基因 ETA、ETB mRNA 除
波生坦组 50 28 17 5 90.00 # 在肺血管的平滑肌细胞上均有较高表达外,ETB mRNA
非波生坦组 32 9 14 9 71.88
在肺血管的内皮细胞上也有较高表达,提示 ET 受体在
#
注:与非波生坦组比较,P<0.05 [4-5]
肺组织里的分布较为密集 。ET-1 与血管平滑肌细胞
Note:vs. non-bosentan group,P<0.05
#
上的 ET 受体 A(ETA)、ETB 结合后,可引起血管强烈收
2.5 不良反应
缩 [22-24] ,导致血管进一步狭窄、阻力增加和血管重构,最
在波生坦治疗期间及停药 1 周内,均未发现有患儿
终导致肺动脉高压形成 [4,25] ;但 ET-1 同时也可与位于内
血清LDH、AST、ALT及Scr水平的变化达到“1.4.4”项下
皮细胞上的 ETB 结合,促进一氧化氮、环前列腺素等扩
与波生坦不良反应有关的水平 。3 组患儿喂养不耐
[13]
血管物质的释放,平衡ET-1 的缩血管作用,并促进ET-1
受、贫血、WBC 及 PLT 减少的发生率比较,差异均无统
的清除 [4-5,25] 。缺氧不仅可通过缺氧反应元件诱导血管
计学意义(P>0.05)。波生坦组中有 3 例患儿发生低血
内皮细胞合成释放更多的ET-1,而且还可使血管平滑肌
压(2例足月儿、1例早产儿),但均合并有严重肺部感染
上 ETA、ETB 表达增多,血管内皮细胞上的 ETB 表达减
及肺出血;非波生坦组有2例、对照组有1例患儿发生低
[25]
少 ,从而导致血管的舒缩功能失衡,这可能也是新生
血压,因样本量过小,未做统计学分析,详见表5。
儿HPH发生的重要机制。近几十年来,国内外对是否可
表5 波生坦不良反应评估[例(%%)]
用ET受体拮抗剂来治疗HPH进行了大量研究,目前《中
Tab 4 Evaluation of bosentan-induced ADR[case(%%)]
[9]
国肺高血压诊断和治疗指南(2018)》 已将波生坦列为
组别 n 喂养不耐受 WBC<2.5×10 L -1 PLT<50×10 L -1 贫血 低血压
9
9
对照组 25 6(24.00) 5(20.00) 6(24.00) 7(28.00) 1(4.00) 治疗成人肺动脉高压的靶向药物之一,但对该药是否也
波生坦组 50 14(28.00) 9(18.00) 8(16.00) 18(36.00) 3(6.00) 可用于新生儿HPH的治疗,国内外学者的关注并不多。
非波生坦组 32 10(31.25) 7(21.88) 8(25.00) 13(40.63) 2(6.25) 波生坦为一种非选择性的 ET 受体拮抗药,可通过
3 讨论 阻滞ET-1与肺血管平滑肌细胞上的ETA、ETB结合而阻
早期低氧性肺血管收缩及随后的低氧性肺血管重 滞 ET-1 的强烈缩血管作用。Mohamed WA 等 在早先
[13]
塑,是 HPH 发生的两个重要环节,前者主要发生在急性 的一项以波生坦治疗 PPHN 的双盲、随机、对照研究中
缺氧时,后者则出现在慢性缺氧时 [1,4,22] 。低氧及胎粪吸 发现,服用波生坦6 h后,患儿的OI开始改善,治疗有效
入综合征、呼吸窘迫综合征、严重感染、窒息等缺氧性疾 率为87.5%;Fatima N等 的一项单盲研究结果显示,波
[15]
病均可引起新生儿肺动脉压增高,其中低氧是最主要的 生坦联合西地那非治疗PPHN,患儿服药3 d后的肺动脉
高危因素 [1,20] 。在本研究中,肺动脉高压患儿的 PaO2、 压下降幅度明显高于单用西地那非者;More K 等 报
[14]
SaO2均显著降低于正常值(PaO2正常值:50~80 mmHg, 道,波生坦无论单独给药或作为 iNO 的辅助用药,患儿
SaO2正常值:88%~95%),与此观点一致。有研究显 缺氧改善状况及机械通气持续时间均显著优于相应的
示,缺氧可引起血管内皮细胞损伤,并促进血管内皮细 对照组;在 Maneenil G 等 的一项回顾性研究中,对轻
[16]
胞ET-1的合成与释放 [3-4] 。ET-1是迄今发现的作用最强 中度PPHN但未达iNO治疗标准的患儿,加用波生坦2 h
的血管收缩因子,在血管收缩、重构以及血栓形成过程 后,其 OI、肺泡-动脉血氧分压差(P A-aO2 )、SaO2均明显改
中发挥了重要作用 。在本研究中,笔者比较了 50 例 善,对重度 PPHN 且予 iNO 治疗效果不好者加用波生坦
[5]
HPH和25例非HPH新生儿治疗前的血清ET-1水平,结 6 h 后的 OI、P A-aO2 及 SaO2 也有明显改善。但 Steinhorn
·1250 · China Pharmacy 2020 Vol. 31 No. 10 中国药房 2020年第31卷第10期