Page 35 - 2019年9月第30卷第18期
P. 35
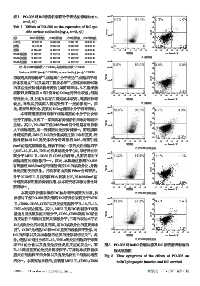
表1 PO-296对DC特异性表面分子表达的影响(x±±s, 5×10 6 10 7
n=3,%%) 4×10 6 10 6
Tab 1 Effects of PO-296 on the expression of DC spe- 10 5
cific surface molecules(x±±s,n=3,%%) FSC-H 2×10 6 7AAD 10 4
组别 MHC Ⅱ阳性细胞 CD80阳性细胞 CD86阳性细胞 CCR7阳性细胞 10 3
imDC组 68.52±1.25 24.68±0.84 13.58±1.12 41.89±2.55 10 2
空载组 98.61±2.85 * 99.55±3.85 * 99.68±0.29 * 41.83±1.25 1
0 10
阳性组 43.78±4.45 # 69.49±3.02 # 55.01±3.56 # 40.40±1.86 10 1 10 2 10 3 10 4 10 5 10 6 10 7 10 1 10 2 10 3 10 4 10 5 10 6 10 7
PO-296低剂量组 97.68±2.32 97.01±3.56 99.18±0.56 41.23±2.56 葡聚糖 PE-Annexin Ⅴ
PO-296中剂量组 78.98±3.65 # 85.08±2.45 # 77.84±2.98 # 40.98±1.85 A. 空载组
PO-296高剂量组 51.48±5.58 # 69.33±3.96 # 61.92±3.56 # 41.23±1.96 5×10 6 10 7
*
#
注:与imDC组比较,P<0.05;与空载组比较,P<0.05 4×10 6 10 6
*
#
Note:vs. imDC group,P<0.05;vs. non-loading group,P<0.05
10 5
[18]
[19]
抑制剂类药物诱导 、细胞凋亡分子表达 、细胞因子培 FSC-H 7AAD 10 4
[20]
养体系建立 以及基因工程技术等 ,但现有临床试验 2×10 6 10 3
[21]
的某些免疫抑制类诱导药物(如阿司匹林、N-乙酰半胱 10 2
氨酸以及环孢素 A 等)诱导的 DCreg 特异性较差,细胞 0 10 1
10 1 10 2 10 3 10 4 10 5 10 6 10 7 10 1 10 2 10 3 10 4 10 5 10 6 10 7
毒性较大,且上述方法存在研究成本较高、周期较长等 葡聚糖 PE-Annexin Ⅴ
缺点,导致其后续深入研究受到了一定的限制 。因 B. 阳性组
[22]
5×10 6
此,亟需寻找安全、高效的DCreg新型小分子诱导药物。 10 7
本课题组前期对抑制 T 细胞增殖的小分子化合物 4×10 6 10 6
进行了筛选,发现了一系列具有抑制活性的苯并噁唑衍 10 5
生物。其中,PO-296 可经 Jak3/Stat5 信号通路有效抑制 FSC-H 2×10 6 7AAD 10 4
10 3
人 T 细胞增殖,是一种新型的免疫抑制剂 。而近期国
[12]
10 2
外研究发现,Jak3在DC的分化成熟过程中非常重要,当
0 10 1
胞外配体与 DC 膜受体结合后可激活 Jak3,继而引起 10 1 10 2 10 3 10 4 10 5 10 6 10 7 10 1 10 2 10 3 10 4 10 5 10 6 10 7
Stat5的酪氨酸磷酸化,启动下游的一系列炎症细胞因子 葡聚糖 PE-Annexin Ⅴ
C. PO-296低剂量组
(如IL-10、IL-12、TNF-α)和共刺激分子(如,即特异性表
5×10 6 10 7
面分子 MHC Ⅱ、CD80 和 CD86)的转录,从而发挥对 T
4×10 6 10 6
细胞增殖的抑制作用 [13-14] 。因此,本课题组推测PO-296
10 5
有可能经Jak3/Stat5信号通路调控DC的成熟分化,并诱 FSC-H 7AAD 10 4
导免疫耐受的发生。托法替尼由美国 Pfizer 公司研发, 2×10 6
10 3
并于2012年11月获美国FDA批准上市,对Jak3/Stat5信 10 2
号通路具有明显的抑制作用,故本研究将其作为阳性对 1
0 10
照药物 。 10 1 10 2 10 3 10 4 10 5 10 6 10 7 10 1 10 2 10 3 10 4 10 5 10 6 10 7
[14]
葡聚糖 PE-Annexin Ⅴ
本研究以骨髓来源的 DC 体外诱导模型为对象,初 D. PO-296中剂量组
步探讨了经PO-296预处理后DC特异性表面分子MHC 5×10 6 10 7
Ⅱ、CD80、CD86、CCR7以及炎症细胞因子IL-10、IL-12、 4×10 6 10 6
TNF-α的表达情况。其中,MHC Ⅱ是 DC 向辅助 T 细胞 10 5
呈递自身抗原肽的关键分子,CD80、CD86则是DC活化 FSC-H 7AAD 10 4
自反应性T细胞的重要共刺激分子,三者的表达水平在 2×10 6 10 3
DC成熟分化后均明显升高,是DC成熟分化的重要标志 10 2
物 。CCR7是成熟DC和imDC重要的趋化因子受体,与 0 10 1
[4]
10 1 10 2 10 3 10 4 10 5 10 6 10 7 10 1 10 2 10 3 10 4 10 5 10 6 10 7
[3]
DC 的归巢以及其向非淋巴组织的迁移密切相关 。此 葡聚糖 PE-Annexin Ⅴ
外,成熟DC通过分泌IL-12、TNF-α等炎症细胞因子来调 E. PO-296高剂量组
控 Th1 的分化以及自身免疫性炎症反应的发生 。而 图3 PO-296对imDC吞噬功能及DC存活情况影响的
[6]
IL-10 则是重要的免疫负调控因子,可抑制单核巨噬细 流式细胞图
胞炎症细胞因子的分泌以及自身免疫性 T 细胞的增殖 Fig 3 Flow cytograms of the effects of PO-296 on
[23]
活化 。本研究结果显示,空载组MHC Ⅱ、CD80、CD86 imDC phagocytic function and DC survival
·2478 · China Pharmacy 2019 Vol. 30 No. 18 中国药房 2019年第30卷第18期