Page 77 - 《中国药房》2025年2期
P. 77
10 4 10 4
ThPOK 32 kDa
10 3 10 3
10 2 10 2 PD-L1 33 kDa
PI PI
10 1 10 1
PD-1 32 kDa
10 0 10 0
10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4
Annexin Ⅴ-FITC Annexin Ⅴ-FITC GAPDH 36 kDa
A.对照组 B. L-IMP-SD组
10 4 10 4
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ
10 3 10 3 Ⅰ:对照组;Ⅱ:L-IMP-SD 组;Ⅲ:M-IMP-SD 组;Ⅳ:H-IMP-SD
组;Ⅴ:si-NC组;Ⅵ:si-ThPOK组。
10 2 10 2
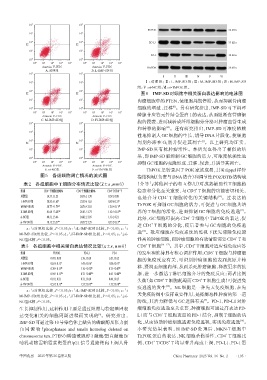
PI PI 图6 IMP-SD对细胞中相关蛋白表达影响的电泳图
10 1 10 1 肉瘤细胞中的PTEN,使细胞周期停滞,从而抑制骨肉瘤
[6]
10 0 10 0 细胞的增殖、迁移 。另有研究指出,IMP-SD 可下调环
10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4
Annexin Ⅴ-FITC Annexin Ⅴ-FITC 磷腺苷应答元件结合蛋白1的表达,从而阻断食管癌细
C. M-IMP-SD组 D. H-IMP-SD组
10 4 10 4 胞的侵袭,进而减弱成纤维细胞旁分泌对肿瘤血管生成
[13]
和转移的影响 。还有研究指出,IMP-SD 可浓度依赖
10 3 10 3
性地抑制人 GC 细胞的生长,诱导 DNA 片段化,使细胞
10 2 10 2 [7]
PI PI 周期停滞在 G1 期并促进其凋亡 。以上研究均证实,
10 1 10 1 IMP-SD 具有抗肿瘤活性。本研究也得出了相似的结
果,即 IMP-SD 能抑制 GC 细胞的活力,可浓度依赖性地
10 0 10 0
10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4 抑制GC细胞的克隆形成、迁移、侵袭,并诱导其凋亡。
Annexin Ⅴ-FITC Annexin Ⅴ-FITC
E. si-NC组 F. si-ThPOK组 ThPOK是转录因子POK家族成员,其Krüppel样锌
图5 各组细胞凋亡情况的流式图 指结构域(负责与DNA结合)和调节性POZ/BTB结构域
表2 各组细胞中T细胞分布情况比较(x±s,n=6) (介导与其他因子的相互作用)对成熟辅助性 T 细胞的
+
组别 CD4 T细胞比例/% CD8 T细胞比例/% CD4 T/CD8 T 稳态和分化至关重要,与CD4 T细胞的功能密切相关,
+
+
+
+
对照组 14.53±1.25 24.76±1.78 0.58±0.08 也是介导 CD4 T 细胞转化的关键结构 。过表达的
[14]
+
L-IMP-SD组 20.82±1.63 a 23.39±1.62 0.89±0.12 a
M-IMP-SD组 30.77±1.79 ab 24.76±2.03 1.24±0.11 ab ThPOK 可抑制 GC 细胞的活力,可促进与 GC 细胞共培
[11]
H-IMP-SD组 41.64±3.28 abc 25.43±2.77 1.63±0.18 abc 养的 T 细胞的活化,进而抑制 GC 细胞的免疫逃逸 。
si-NC组 40.51±3.46 24.82±2.95 1.63±0.21 此外,GC 细胞可提高 CD4 T 细胞中 ThPOK 的表达,促
+
si-ThPOK组 18.12±3.51 de 24.77±2.75 0.73±0.13 de
进 CD4 T 细胞的分化,使后者参与 GC 细胞的免疫逃
+
a:与对照组比较,P<0.05;b:与L-IMP-SD组比较,P<0.05;c:与 [15]
M-IMP-SD组比较,P<0.05;d:与H-IMP-SD组比较,P<0.05;e:与si- 逸 。效应细胞在免疫系统的监视下优先清除免疫原
+
NC组比较,P<0.05。 性高的肿瘤细胞,而肿瘤细胞的有效清除需要CD4 T和
+
+
表3 各组细胞中相关蛋白表达情况比较(x±s,n=6) CD8 T细胞 [16―17] 。其中,CD4 T细胞对适应性免疫应答
+
组别 ThPOK PD-L1 PD-1 的发生和维持具有核心调控作用;CD8 T细胞与肿瘤细
对照组 0.47±0.08 1.76±0.18 1.45±0.15 胞的免疫反应有关,可识别肿瘤细胞的表面抗原并转
L-IMP-SD组 0.63±0.12 a 1.43±0.16 a 1.08±0.17 a
M-IMP-SD组 0.78±0.13 ab 1.16±0.12 ab 0.73±0.07 ab 移、浸润至细胞内部,从而杀死肿瘤细胞,释放更多的抗
H-IMP-SD组 0.94±0.15 abc 0.73±0.08 abc 0.45±0.08 abc 原,进一步激活 T 淋巴细胞介导的免疫反应;两者比例
si-NC组 0.91±0.21 0.71±0.18 0.44±0.17 失衡(如CD8 T细胞耗竭而CD4 T细胞生成)可促进免
+
+
si-ThPOK组 0.53±0.12 de 1.55±0.15 de 1.12±0.18 de [18]
疫逃逸的发生 。NK 细胞是一种先天免疫细胞,在先
a:与对照组比较,P<0.05;b:与L-IMP-SD组比较,P<0.05;c:与
M-IMP-SD组比较,P<0.05;d:与H-IMP-SD组比较,P<0.05;e:与si- 天免疫防御中发挥重要作用,是抵御恶性肿瘤的第一道
[2]
NC组比较,P<0.05。 防线,其活力降低与 GC 进展有关 。PD-1、PD-L1 对肿
生长抑制作用,这种作用主要是通过阻滞与特定基因表 瘤细胞免疫逃逸至关重要,肿瘤细胞可通过高表达 PD-
+
达变化相关的细胞周期进程而实现的 。研究指出, L1 而与 CD8 T 细胞表面的 PD-1 结合,抑制 T 细胞的活
[5]
[19]
IMP-SD可通过第10号染色体上缺失的磷酸酶及张力蛋 化,从而协助肿瘤细胞逃避免疫监视,实现免疫逃逸 。
白 同 源 物(phosphatase and tensin homolog deleted on 本研究结果表明,经 IMP-SD 处理后,MKN-7 细胞中
+
chromosome ten,PTEN)/磷脂酰肌醇3激酶/蛋白激酶B/ ThPOK 蛋白的表达、NK 细胞杀伤活性,CD4 T 细胞比
+
+
哺乳动物雷帕霉素靶蛋白/p21 信号通路靶向上调人骨 例、CD4 T/CD8 T 均显著升高或上调,PD-L1、PD-1 蛋
中国药房 2025年第36卷第2期 China Pharmacy 2025 Vol. 36 No. 2 · 195 ·