Page 50 - 《中国药房》2024年24期
P. 50
表5 各组大鼠骨微结构参数比较(x±s,n=4)
组别 BMD/(mg/cm) (BV/TV)/% Tb.N/mm -1 Tb.Sp/mm Tb.Th/mm
3
假手术组 9.74±0.48 25.59±4.12 3.21±0.67 0.20±0.09 0.09±0.02
模型组 12.35±0.61 a 31.64±1.85 0.84±0.13 a 1.27±0.15 a 0.20±0.01 a
中华跌打丸组 16.61±1.57 b 38.86±2.49 b 1.24±0.14 0.66±0.19 b 0.33±0.06 b
野生接骨木组 15.94±0.96 b 34.38±3.10 1.14±0.17 0.67±0.19 b 0.29±0.03
盐丹低剂量组 13.39±0.59 33.37±1.84 1.09±0.16 0.98±0.16 0.28±0.04
盐丹中剂量组 15.17±0.75 b 34.08±2.82 1.18±0.19 0.71±0.30 b 0.30±0.05 A.模型组 B.中华跌打丸组
盐丹高剂量组 16.77±1.18 b 43.73±3.47 b 1.75±0.28 b 0.56±0.09 b 0.33±0.06 b
a:与假手术组比较,P<0.05;b:与模型组比较,P<0.05。
C.野生接骨木组 D.盐丹低剂量组
b
A.模型组 B.中华跌打丸组
E.盐丹中剂量组 F.盐丹高剂量组
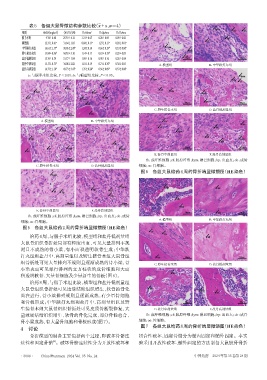
fb:成纤维细胞;cf:胶原纤维;lym:淋巴细胞;bp:出血点;ob:成骨
C.野生接骨木组 D.盐丹低剂量组 细胞;os:骨细胞。
图6 各组大鼠给药4周的骨折端显微镜图(HE染色)
E.盐丹中剂量组 F.盐丹高剂量组
fb:成纤维细胞;cf:胶原纤维;lym:淋巴细胞;bp:出血点;ob:成骨
A.模型组 B.中华跌打丸组
细胞;os:骨细胞。
图5 各组大鼠给药2周的骨折端显微镜图(HE染色)
给药4周,与假手术组比较,模型组和盐丹低剂量组
大鼠骨组织骨折处局部有轻度出血,可见大量排列不规
则且不成熟的骨小梁,有小面积透明软骨生成;中华跌
打丸组和盐丹中、高剂量组以及野生接骨木组大鼠骨组
织骨折处可见大量排列不规则且逐渐成熟的骨小梁,骨 C.野生接骨木组 D.盐丹低剂量组
小梁表面可见单行排列的立方柱状的成骨细胞和大面
积透明软骨、大量骨细胞及少量新生的骨板(图6)。
给药8周,与假手术组比较,模型组和盐丹低剂量组
大鼠骨组织骨折处可见边缘结缔组织增生,软骨的骨化
尚在进行,骨小梁排列规则且逐渐成熟,有少量骨细胞
和骨板形成;中华跌打丸组和盐丹中、高剂量组以及野
生接骨木组大鼠骨组织骨折处可见皮质骨断裂修复,大 E.盐丹中剂量组 F.盐丹高剂量组
量致密结缔组织增生,软骨的骨化完成,部分骨性愈合, fb:成纤维细胞;cf:胶原纤维;lym:淋巴细胞;bp:出血点;ob:成骨
骨小梁成熟,有大量骨细胞和骨板形成(图7)。 细胞;os:骨细胞。
图7 各组大鼠给药8周的骨折端显微镜图(HE染色)
4 讨论
骨折模型的制备主要包括两个过程,即破坏骨骼连 闭合性破坏,固定骨骼分为髓内固定和髓外固定。本实
[8]
续性和固定骨骼 。破坏骨骼连续性分为开放性破坏和 验采用开放性破坏、髓外固定的方法制备大鼠股骨骨折
· 3008 · China Pharmacy 2024 Vol. 35 No. 24 中国药房 2024年第35卷第24期