Page 46 - 《中国药房》2024年13期
P. 46
DMEM 培养基,接种于 Transwell 小室的下层。将上室 值表示目的蛋白的表达水平,并计算 cleaved-caspase-3
细胞按“2.2”项下方法分组、干预。培养 24 h,收集穿膜 与 caspase-3 蛋白的表达水平比值(cleaved-caspase-3/
细胞,用多聚甲醛固定,再以结晶紫染液染色,冲洗、晾 caspase-3)。
干后,使用显微镜观察侵袭细胞(呈紫色)并计数。 2.8 统计学方法
2.6 HeLa/DDP细胞中YAP、TAZ mRNA表达水平检测 采用GraphPad Prism 7.0软件对数据进行统计分析。
采用定量实时聚合酶链式反应(quantitative real-
数据以x±s表示。多组间比较采用单因素方差分析,进
time PCR,qRT-PCR)法检测。取对数生长期的 HeLa/
一步两两比较采用LSD-t检验。检验水准α=0.05。
DDP 细胞,接种于 96 孔板中,按“2.2”项下方法分组、干
3 结果
预。培养24 h,收集细胞,以PBS清洗后加入Trizol试剂
3.1 藁本内酯对HeLa/DDP细胞增殖抑制率的影响
提取 RNA;将所得 RNA 反转录为 cDNA 后进行 PCR 扩
与对照组比较,顺铂组细胞的增殖抑制率显著升高
增。PCR反应体系包括正、反向引物各0.4 μL,cDNA模
(P<0.05);与顺铂组比较,顺铂+低、中、高浓度藁本内
板 5 μL,mix 10 μL,ddH2O 4.2 μL。PCR 反应条件为
95 ℃预变性 30 s;95 ℃变性 30 s,60 ℃退火 5 s,循环 38 酯组细胞的增殖抑制率亦显著升高,且呈浓度依赖性
次;72 ℃延伸 15 s。以甘油醛-3-磷酸脱氢酶(GAPDH) (P<0.05)。结果见图1A。
为内参,使用 2 -ΔΔCt 法分析 YAP、TAZ mRNA 的表达水 80 50
bcd
40
平,结果以对照组作为参照进行归一化处理。PCR引物 60 bcd bc
序列及产物长度见表1。 增殖抑制率/% 40 bc 凋亡率/% 30 b
表1 PCR引物序列及产物长度 20 a b 20 a
目的基因 引物序列 产物长度/bp 10
YAP 正向:5′-CGCTCTTCAACGCCGTCA-3′ 167 0 0
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ
反向:5′-AGTACTGGCCTGTCGGGAGT-3′ A.增殖抑制率 B.凋亡率
TAZ 正向:5′-CAGCAATGTGGATGAGATGG-3′ 118 Ⅰ:对照组;Ⅱ:顺铂组;Ⅲ:顺铂+低浓度藁本内酯组;Ⅳ:顺铂+中
反向:5′-TCATTGAAGAGGGGGATCAG-3′
GAPDH 正向:5′-TCAAGAAGGTGGTGAAGCAGG-3′ 123 浓度藁本内酯组;Ⅴ:顺铂+高浓度藁本内酯组;a:与对照组比较,P<
0.05;b:与顺铂组比较,P<0.05;c:与顺铂+低浓度藁本内酯组比较,
反向:5′-TCAAAGGTGGAGGAGTGGGT-3′
P<0.05;d:与顺铂+中浓度藁本内酯组比较,P<0.05。
2.7 HeLa/DDP细胞中相关蛋白表达水平检测
图1 藁本内酯对 HeLa/DDP 细胞增殖抑制率、凋亡率
采用 Western blot 法检测。取对数生长期的 HeLa/ 的影响(x±s,n=6)
DDP 细胞,接种于 96 孔板中,按“2.2”项下方法分组、干
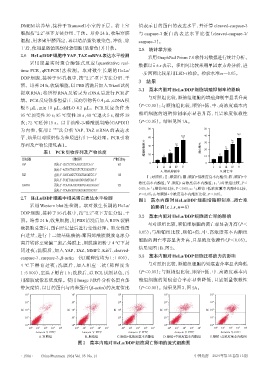
3.2 藁本内酯对HeLa/DDP细胞凋亡率的影响
预。培养24 h,收集细胞,用PBS清洗后加入RIPA裂解
与对照组比较,顺铂组细胞的凋亡率显著升高(P<
液提取总蛋白,蛋白经定量后进行变性处理。取变性蛋
0.05);与顺铂组比较,顺铂+低、中、高浓度藁本内酯组
白适量,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分
细胞的凋亡率亦显著升高,且呈浓度依赖性(P<0.05)。
离并转移至聚偏二氟乙烯膜上,用脱脂奶粉于4 ℃下封
结果见图1B、图2。
闭过夜;洗膜后,加入 YAP、TAZ、MMP2、Ki67、cleaved-
caspase-3、caspase-3、β-actin一抗(稀释度均为1︰1 000), 3.3 藁本内酯对HeLa/DDP细胞迁移能力的影响
4 ℃下孵育过夜;洗膜后,加入相应二抗(稀释度为 与对照组比较,顺铂组细胞的划痕愈合率显著降低
1︰5 000),室温下孵育1 h;洗膜后,以ECL试剂显色,再 (P<0.05);与顺铂组比较,顺铂+低、中、高浓度藁本内
用凝胶成像系统成像。使用Image J软件分析各蛋白条 酯组细胞的划痕愈合率亦显著降低,且呈剂量依赖性
带灰度值,以目的蛋白与内参蛋白(β-actin)的灰度值比 (P<0.05)。结果见图3、图4A。
10 4 10 4 10 4 10 4 10 4
10 3 10 3 10 3 10 3 10 3
PI 10 2 PI 10 2 PI 10 2 PI 10 2 PI 10 2
10 1 10 1 10 1 10 1 10 1
10 0 10 0 10 0 10 0 10 0
10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4
Annexin Ⅴ-FITC Annexin Ⅴ-FITC Annexin Ⅴ-FITC Annexin Ⅴ-FITC Annexin Ⅴ-FITC
A.对照组 B.顺铂组 C.顺铂+低浓度藁本内酯组 D.顺铂+中浓度藁本内酯组 E.顺铂+高浓度藁本内酯组
图2 藁本内酯对HeLa/DDP细胞凋亡影响的流式细胞图
· 1584 · China Pharmacy 2024 Vol. 35 No. 13 中国药房 2024年第35卷第13期