Page 71 - 《中国药房》2024年10期
P. 71
(2)内标溶液。精密称取槲皮素对照品5.00 mg,置 2.3.7 标准曲线绘制和定量下限考察
于10 mL容量瓶中,加入适量乙腈,超声溶解10 min,放 精密吸取空白血浆100 µL,分别加入“2.3.3”项下系
置至室温后,定容,摇匀,即得质量浓度为 500 µg/mL 的 列质量浓度的对照品溶液 20 µL,得到质量浓度分别为
槲皮素对照品储备液;取上述储备液适量,用乙腈稀释, 1 000、800、400、100、10、2、1 ng/mL 的校正标样。按照
得到质量浓度为1 µg/mL的内标溶液。 “2.3.5”项下方法处理后,再按照“2.3.1”和“2.3.2”项下条
2.3.4 空白血浆的处理 件进样分析,以木犀草素质量浓度为横坐标(x)、木犀草
精密吸取空白血浆 100 µL,加入乙腈 40 µL,涡旋 素与内标的峰面积比值为纵坐标(y)进行线性回归(权重
2
1 min,再加入乙腈 400 µL 沉淀蛋白,涡旋 5 min,静置 系数为1/x),得到木犀草素的标准曲线为y=0.017 04x-
2
1 min后,离心(10 000 r/min,下同)10 min,取上清液,再 0.003 10(R =0.999 0),表明木犀草素检测质量浓度的线
离心10 min,取上清液100 µL,即得。 性范围为1~1 000 ng/mL,定量下限为1 ng/mL。
2.3.8 精密度和准确度试验
2.3.5 含药血浆的处理
取空白血浆 100 µL,加入已知含量的木犀草素对
精密吸取含药血浆 100 µL,加入“2.3.3(2)”项下内
照品溶液,按照“2.3.7”项下方法分别制备定量下限(1
标溶液20 µL和乙腈 20 µL,涡旋1 min,再加入乙腈 400
ng/mL)及低、中、高质量浓度(2、400、800 ng/mL)的质控
µL 沉淀蛋白,涡旋 5 min,静置 1 min 后,离心 10 min,取
样品,每个浓度各6份。按照“2.3.5”项下方法处理后,再
上清液,再离心10 min,取上清液100 µL,即得。
按照“2.3.1”和“2.3.2”项下条件进样分析,考察日内精密
2.3.6 专属性考察
度;连续测定 3 d,考察日间精密度;将实测质量浓度与
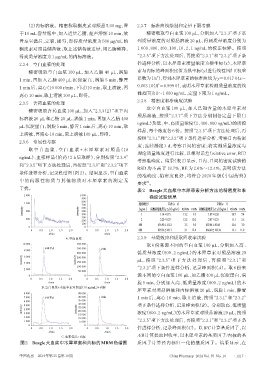
取 空 白 血 浆 、空 白 血 浆 + 木 犀 草 素 对 照 品(10
理论质量浓度进行比较,以相对误差(relative error,RE)
ng/mL)、血浆样品(给药 12 h 后取样),分别按照“2.3.4”
考察准确度。结果(表2)显示,日内、日间精密度试验的
和“2.3.5”项下方法处理后,再按照“2.3.1”和“2.3.2”项下
RSD 均不高于 18.7%,RE 为 2.6%~12.4%,表明该方法
条件进样分析,记录色谱图(图2)。结果显示,空白血浆
的准确度、精密度良好,均符合 2020 年版《中国药典》
中的内源性物质与其他物质对木犀草素的测定无
[6]
要求 。
干扰。
表2 Beagle犬血浆中木犀草素分析方法的精密度和准
1 600 1 000 确度试验结果
900
800
1 200 理论浓度/ 日内(n=6) 日间(n=3)
700
intensity 800 intensity 500 (ng/mL) 实测质量浓度(x±s)/(ng/mL) RSD/% RE/% 实测质量浓度(x±s)/(ng/mL) RSD/% RE/%
600
400
300 1 1.14±0.15 13.2 9.3 1.07±0.20 18.7 7.4
400 2 2.20±0.27 12.2 10.2 2.07±0.23 11.1 2.6
200
100 400 436.90±15.12 3.5 9.2 407.44±50.44 12.4 3.0
0 0
0 0.5 1.0 1.5 2.0 0 0.5 1.0 1.5 2.0 800 899.36±28.17 3.1 12.4 868.60±105.36 12.1 11.0
t/min t/min
A.空白血浆 2.3.9 基质效应和提取回收率试验
10 000 350 000 取 6 份来源不同的空白血浆 100 µL,分别加入高、
木犀草素 300 000 内标
8 000
250 000 低质量浓度(800、2 ng/mL)的木犀草素对照品溶液 20
intensity 6 000 intensity 200 000 µL,按 照“2.3.5”项 下 方 法 处 理 后 ,再 按 照“2.3.1”和
150 000
4 000
100 000 “2.3.2”项下条件进样分析,记录峰面积(A)。取 6 份来
2 000
50 000
0 0 源不同的空白血浆 100 µL,加乙腈 400 µL 沉淀蛋白,涡
0 0.5 1.0 1.5 2.0 0 0.5 1.0 1.5 2.0
t/min t/min 旋 5 min,分别加入高、低质量浓度(800、2 ng/mL)的木
B.空白血浆+木犀草素对照品(10 ng/mL)+内标
犀草素对照品溶液和内标溶液 20 µL,涡旋 1 min,静置
8 000 45 000
7 000 木犀草素 40 000 内标 1 min 后,离心 10 min,取上清液,按照“2.3.1”和“2.3.2”
6 000 35 000 项下条件进样分析,记录峰面积(B)。分别取高、低质量
30 000
5 000
intensity 4 000 intensity 25 000 浓度(800、2 ng/mL)的木犀草素对照品溶液20 µL,按照
20 000
3 000
2 000 15 000
10 000
1 000 5 000 “2.3.5”项下方法处理后,再按照“2.3.1”和“2.3.2”项下条
0 0
0 0.5 1.0 1.5 2.0 0 0.5 1.0 1.5 2.0 件进样分析,记录峰面积(C)。以B/C计算基质因子,以
t/min t/min
C.血浆样品+内标 A/B计算提取回收率,以木犀草素的基质因子/内标的基
图2 Beagle犬血浆中木犀草素和内标的MRM色谱图 质因子计算经内标归一化的基质因子。结果显示,在
中国药房 2024年第35卷第10期 China Pharmacy 2024 Vol. 35 No. 10 · 1217 ·