Page 82 - 《中国药房》2023年23期
P. 82
2.2 BMECs-PC12 共培养体系构建和 OGD/R 损伤模 细胞中LDH活性。
型的建立 2.5 PC12细胞中BDNF水平的检测
分 别 取 PC12 细 胞 和 BMECs,以 磷 酸 盐 缓 冲 液 “2.4”项下实验结束后,取板底PC12细胞的培养液,
(PBS)洗涤 2 次,加入 0.25% 胰酶置于 37 ℃培养箱中消 然后按 ELISA 试剂盒说明书方法操作,检测 PC12 细胞
化 5 min;当 80% 细胞收缩变圆并漂浮时,向 PC12 细胞 中BDNF水平。
中立即加入含 10%FBS 的 DMEM/RPMI 1640 培养基终 2.6 PC12 细胞中 TrkB、Plc-γ、Map-2、GAP-43 mRNA
止消化,向 BMECs 中加入含 20%FBS 的 DMEM/F12 培 表达水平的检测
养基终止消化;将两种细胞以1 000 r/min离心5 min,收 采用荧光定量 PCR 法进行检测。“2.4”项下实验结
集管底细胞沉淀,加入培养基重悬,调整 PC12 细胞、 束后,取部分PC12细胞进行裂解,然后用相应试剂盒提
6
BMECs 的 密 度 分 别 至 1.0×10 、4.0×10 个/mL。 将 取总 RNA,逆转录合成 cDNA,再以 cDNA 进行 PCR,反
5
PC12 细胞接种于 6 孔板中,待其生长 1 d 后用于共培养 应条件为:50 ℃预处理 2 min;95 ℃预变性 2 min;95 ℃
实验。将BMECs接种于已提前包被好明胶的Transwell 变性15 s,60 ℃退火1 min,72 ℃延伸7 min,循环40次。
小室内侧,将插入室放入已接种PC12细胞的6孔板中共 以GAPDH为内参,采用2 -ΔΔCt 法检测PC12细胞中TrkB、
培养2 d。当两种细胞生长密度达90%时,检测BMECs- Plc-γ、Map-2、GAP-43 mRNA的表达水平。
PC12 共培养体系的跨膜电阻(transendothelial electronic 2.7 统计学方法
resistance,TEER)、PC12 细胞中 LDH 活性;当 BMECs- 采用 GraphPad Prism 8.0.1 软件进行统计学分析。
PC12 共培养体系的 TEER 和其中 PC12 细胞中 LDH 活 数据以 x±s 表示,多组间比较采用单因素方差分析;符
性 相 较 于 两 种 细 胞 单 独 培 养 显 著 升 高 时 ,则 表 明 合正态分布且方差齐时,组间两两比较采用 Dunnett’s t
[10]
BMECs-PC12共培养体系构建成功 。 检验;不符合正态分布时,采用秩和检验。检验水准
将上述BMECs-PC12共培养体系取出,弃掉原培养 α=0.05。
基,以PBS清洗细胞后,换入无糖无血清培养基,置于含 3 结果
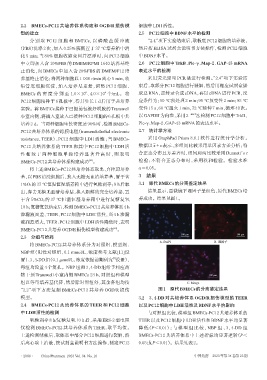
1%O2的37 ℃恒温恒湿培养箱中进行氧糖剥夺;8 h后取 3.1 原代BMECs的分离鉴定结果
出,弃去无糖无血清培养基,换入新鲜的完全培养基,置 结果显示,显微镜下Ⅷ因子呈红色,原代BMECs培
于含 5%CO2的 37 ℃恒温恒湿培养箱中进行复糖复氧 养成功。结果见图1。
10 h;复糖复氧结束后,检测BMECs-PC12共培养体系4 h
渗漏液面差、TEER、PC12 细胞中 LDH 活性,当 4 h 渗漏
液面差增大,TEER、PC12细胞中LDH活性降低时,表明
[10]
BMECs-PC12共培养OGD/R损伤模型构建成功 。
100 μm 100 μm
2.3 分组与给药
A. DAPI B. Ⅷ因子
将 BMECs-PC12 共培养体系分为对照组、模型组、
NBP 组(阳性对照组,0.1 mmol/L,浓度参考文献[11]设
[7]
置)、3,4-DD组(0.1 μmol/L,浓度依据前期研究 设置),
每组均设置4个复孔。NBP组和3,4-DD组给予相应药
物干预 Transwell 小室内侧 BMECs 24 h,对照组和模型 100 μm
组以等量培养基代替,然后除对照组外,其余各组均按 C. Merge
“2.2”项下方法复制 BMECs-PC12 共培养 OGD/R 损伤 图1 原代BMECs的分离鉴定结果
模型。 3.2 3,4-DD 对共培养体系 OGD/R 损伤模型的 TEER
2.4 BMECs-PC12 共培养体系的 TEER 和 PC12 细胞 以及PC12细胞中LDH活性及BDNF水平的影响
中LDH活性的检测 与对照组比较,模型组BMECs-PC12共培养体系的
氧糖剥夺 8 h/复糖复氧 10 h 后,采用 ERS-2 型电阻 TEER 以及 PC12 细胞中 LDH 活性和 BDNF 水平均显著
仪检测 BMECs-PC12 共培养体系的 TEER,取平均值。 降 低(P<0.01);与 模 型 组 比 较 ,NBP 组 、3,4-DD 组
上述检测结束后,取体系中部分PC12细胞进行裂解,然 BMECs-PC12 共培养体系中上述指标均显著逆转(P<
后离心取上清液,按试剂盒说明书方法操作,测定PC12 0.05或P<0.01)。结果见表2。
· 2888 · China Pharmacy 2023 Vol. 34 No. 23 中国药房 2023年第34卷第23期