Page 83 - 《中国药房》2023年15期
P. 83
孔,每孔加入含1%PBS的DMEM培养基,继续培养。各 2.8 统计学方法
组细胞分别于给药 0、24、36 h 时在同一位置拍照,记录 采用SPSS 24.0软件进行数据的统计分析。计量资
划痕宽度,并计算细胞迁移率。细胞迁移率(%)=(给 料以x±s表示,组间比较用单因素方差分析和LSD-t检
药0 h时划痕宽度-给药24 h或36 h时划痕宽度)/给药 验。采用 GraphPad Prism 8.0 作图工具作图。检验水准
0 h时划痕宽度×100%。 α=0.05。
2.5 BER对细胞侵袭能力的影响 3 结果
采用Transwell实验进行检测。按“2.3”项下方法进 3.1 BER对OSRC-2细胞增殖的影响结果
行细胞接种、分组(每组设置3个复孔)、给药及培养,常
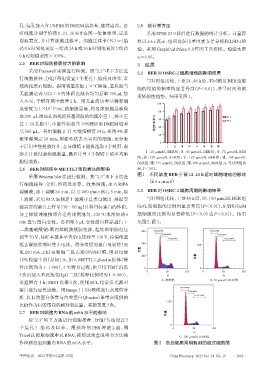
与对照组比较,干预24、48 h后,不同浓度BER组细
规消化离心细胞。提前将基质胶于4 ℃解冻,基质胶与
胞的增殖抑制率均显著升高(P<0.01),并呈时间和浓
无血清培养基以 1∶8 的体积比混合均匀后取 100 µL 加
度依赖性趋势。结果见图1。
入小室,于孵育箱中放置 2 h。用无血清培养基稀释制
100 a a a a
成密度为 1×10 个/mL 的细胞悬液,将各组细胞悬液吸 a a a a a a a
5
80 a a a
取200 μL滴加在预先铺好基质胶的细胞小室上,将小室 60 a a 24 h
置于 24 孔板中,小室外添加含 10%PBS 的 DMEM 培养 增殖抑制率/% 40 48 h
基500 μL。各组细胞于37 ℃继续孵育24 h,采用4%多
20
聚甲醛固定 20 min,用棉签拭去小室内的细胞,充分晾
0
干后用中性树胶封片,在显微镜下随机选取4个视野,观 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ Ⅷ
Ⅰ:25 μmol/L BER组;Ⅱ:50 μmol/L BER组;Ⅲ:75 μmol/L BER
察并计数侵袭细胞数量,最后计算4个视野下的平均细
组;Ⅳ:100 μmol/L BER组;Ⅴ:125 μmol/L BER组;Ⅵ:150 μmol/L
胞侵袭数。 BER组;Ⅶ:175 μmol/L BER组;Ⅷ:200 μmol/L BER组;a:与对照组比
2.6 BER对细胞中METTL3蛋白表达的影响 较,P<0.01。
图1 不同浓度BER干预24、48 h后对细胞增殖的影响
采用Western blot法进行检测。按“2.3”项下方法进
(x±s,n=6)
行细胞接种、分组、给药及培养。收集细胞,加入 RIPA
裂解液,冰上裂解 30 min,以 12 000 r/min 离心 5 min,取 3.2 BER对OSRC-2细胞周期的影响结果
上清液,采用BCA法测定上清液中总蛋白浓度,根据实 与对照组比较,干预48 h后,50、100 μmol/L BER组
验需要的蛋白上样量(30~50 ng)计算目标蛋白的体积, G0/G1期细胞的比例均显著升高(P<0.01),S 期和 G2/M
与上样缓冲液按照合适的比例混匀,100 ℃水浴加热 6 期细胞的比例均显著降低(P<0.05 或 P<0.01)。结果
min 进行蛋白变性。各组取 5 µL 变性蛋白样品进行十 见图2、图3。
二烷基硫酸钠-聚丙烯酰胺凝胶电泳,起始浓缩胶电压 600 P3(57.07%) P3(75.57%)
P4(20.82%) P4(9.17%)
调至70 V,待样本基本平齐后电压转至130 V,待溴酚蓝 P5(22.75%) P5(15.45%)
抵达凝胶底部时终止电泳。将分离后的蛋白电转移(电 400 500
流 200 mA,2 h)至聚偏二氟乙烯(PVDF)膜,用封闭液 数量
200 数量
(5% 脱脂牛奶)封闭 1 h,加入 METTL3、β-actin 抗体(稀
释比例均为1∶1 000),4 ℃孵育过夜;次日用TBST清洗 0 0
0 50 100 0 50 100
4次后加入羊抗兔/鼠IgG二抗(稀释比例均为1∶3 000), PI PI
A.对照组 B. 50 μmol/L BER组
室温孵育 1 h;TBST 洗涤 3 次,使用 ECL 化学发光液对
蛋白进行显色成像。用Image J 1.53t软件进行灰度值分 P3(72.29%) P4(9.92%)
析,以目的蛋白条带与内参蛋白(β-actin)条带灰度值的 P5(17.55%)
500
比值作为目的蛋白的相对表达量。实验重复3次。
2.7 BER对细胞内RNA的m6A水平的影响 数量
按“2.3”项下方法进行细胞接种、分组(每组设置 3
0
个复孔)、给药及培养。用预冷的 PBS 冲洗 2 遍,用 0 50 100
PI
Trizol 法提取细胞中总 RNA,按照试剂盒说明书方法操 C. 100 μmol/L BER组
作检测各组细胞内RNA的m6A水平。 图2 各组细胞周期检测的流式细胞图
中国药房 2023年第34卷第15期 China Pharmacy 2023 Vol. 34 No. 15 · 1865 ·