Page 81 - 2021年18期
P. 81
表3 PPD及内标的提取回收率与基质效应(n=6) 2、3、4、6、8、12、24 h采血5 mL以及于末次服药前30 min
Tab 3 Extraction recovery rates and matrix effects of 及服药后0.25、0.5、1、1.5、2、3、4、6、8、12、24、48、72、96 h
PPD and internal standard(n=6) 采血5 mL用于血药浓度测定。使用含乙二胺四乙酸二
基质效应 钾(EDTA-K2 )抗凝剂的真空采血管采集血样,于4 ℃下以
提取回收率
待测 理论质量浓 空白血浆 溶血血浆 高脂血浆 3 000 r/min离心10 min,分离血浆,-70 ℃保存,待测。
成分 度,ng/mL 结果(x±s), RSD, 结果 RSD, 结果 RSD, 结果 RSD,
% % (x±s) % (x±s) % (x±s) % 2.12.2 样品测定及数据分析 取 3 个剂量组受试者各
PPD 0.75 98.43±6.39 6.49 1.07±0.06 5.61 0.99±0.14 14.14 1.12±0.09 8.03 采血点的血浆样品,稀释至线性范围内,按“2.4”项下方
4.50 100.35±2.64 2.63 0.93±0.05 5.38 0.99±0.07 7.07 1.00±0.08 8.00 法处理后,再按“2.1”“2.2”项下条件进样测定,记录峰面
22.50 100.30±1.72 1.71 0.87±0.03 3.45 0.88±0.03 3.41 0.92±0.06 6.52
内标 10. 103.90±0.89 0.86 0.97±0.02 1.99 0.92±0.02 2.35 0.94±0.02 2.16 积。使用 AB Analyst 1.6.3 软件对数据进行采集和定量
分析,通过随行标准曲线计算各待测样品中PPD的质量
性,处理后在进样器条件(10 ℃)下放置27 h的稳定性,
浓度,得到3个剂量组受试者给药第1天和给药第84天
处理后在进样条件(10 ℃)下放置24 h再进样的稳定性,
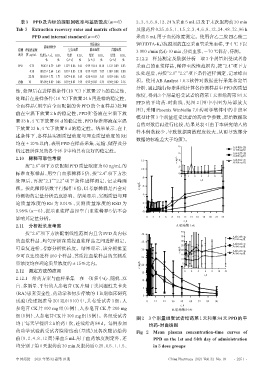
PPD 的平均药-时曲线,见图 2(图中小图为局部放大
全血样品(用空白全血配制的含 PPD 的全血样品)处理
图);采用 Phoenix WinNolin 7.0 药动学软件中的非房室
前在室温下放置 2 h 的稳定性,PPD 贮备液在室温下放
模型计算3个剂量组受试者的药动学参数,原始数据取
置33 h、4 ℃下放置66 d的稳定性,PPD标准溶液在室温
自然对数后再进行比较,结果见表4(由于本研究纳入的
下放置 33 h、4 ℃下放置 8 d 的稳定性。结果显示,在上
样本例数较少,导致数据离散程度较大,从而导致部分
述条件下,各样品实测质量浓度与理论质量浓度的 RE
数据的标准差大于均值)。
均在±10%以内,表明PPD在样品采集、运输、储存及分
8 人参皂苷CK
析过程所涉及的各个环节中均具有良好的稳定性。 片100 mg组
6 人参皂苷CK
2.10 稀释可靠性考察 ng/L 片200 mg组
12 c, 4 人参皂苷CK
片300 mg组
按“2.6”项下方法配制PPD质量浓度为60 ng/mL的 2
10
标准血浆样品,用空白血浆稀释 5 倍,按“2.4”项下方法 0
8 0 1 2 3 4 5 6
处理后,再按“2.1”“2.2”项下条件进样测定,记录峰面 t,h
ng/L 6
积。按此稀释倍数平行操作6份,以考察稀释是否会对 c,
待测物的定量分析造成影响。结果显示,实测质量与理 4
论质量浓度的 RE 为 0.01%,实测质量浓度的 RSD 为 2
3.98%(n=6),提示血浆样品经空白血浆稀释 5 倍不会 0
影响其定量分析。 0 2 4 6 8 10 12 14 16 18 20 22 24
t,h
2.11 分析批长度考察 A.给药第1天
按“2.6”项下方法配制线性范围内且含 PPD 及内标 40 40
35 人参皂苷CK
的血浆样品,均匀穿插在质控血浆样品之间进样测定, 35 30 片100 mg组
人参皂苷CK
可重复进样,考察分析批长度。结果显示,该分析批至 30 ng/L 25 片200 mg组
c, 20
人参皂苷CK
少可以连续进样 160 个样品,其质控血浆样品的实测质 25 15 片300 mg组
10
量浓度均在理论质量浓度的±15%之内。 ng/L c, 20 5
2.12 测定方法的应用 15 0 0 2 4 6 8 10 12
t,h
2.12.1 给药方案与血样采集 在一项多中心、随机、双 10
盲、多剂量、平行的人参皂苷CK片用于类风湿性关节炎
5
(RA)患者安全性、药动学和初步疗效的ⅠB期临床研究
0
试验(伦理批准号 2013L01910)中,共有受试者 3 组:人 0 12 24 36 48 60 72 84 96
t,h
参皂苷 CK 片 100 mg 组(6 例)、人参皂苷 CK 片 200 mg B.给药第84天
组(5例)、人参皂苷CK片300 mg组(5例)。各组受试者
图2 3个剂量组受试者给药第1天和第84天PPD的平
均于每天早餐后2 h给药1次,连续给药84 d。每例参加 均药-时曲线图
药动学试验的受试者除筛选前(基线)及各次随访给药 Fig 2 Mean plasma concentration-time curves of
前(0、2、4、8、12 周)采血 5 mL 用于血药浓度测定外,还 PPD on the 1st and 84th day of administration
均分别于第1天服药前30 min及服药后0.25、0.5、1、1.5、 in 3 dose groups
中国药房 2021年第32卷第18期 China Pharmacy 2021 Vol. 32 No. 18 ·2251 ·