Page 82 - 《中国药房》2021年10期
P. 82
别为 102.51%、99.16%,RSD 分别为 2.05%、2.58%(n=
2.0
6),表明该方法准确度高。金丝桃苷、异槲皮苷的加样
1.5
回收率测定结果见表5。
VIP值 1.0 表5 金丝桃苷、异槲皮苷的加样回测定结果(n=6)
0.5
Tab 5 Results of recovery tests of hyperoside and iso-
0
quercitrin(n=6)
-0.5
称样量, 已知含量, 加入量, 测得量, 加样回收率, 平均加样回收率, RSD,
4 3 10 2 6 11 5 1 8 7 9 待测成分
峰号 g mg mg mg % % %
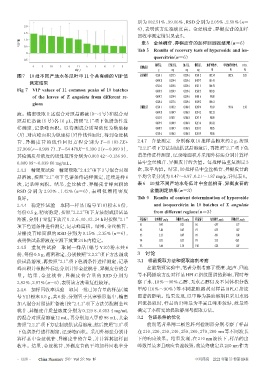
图 7 10 批不同产地水冬瓜叶中 11 个共有峰的 VIP 值 金丝桃苷 0.5011 0.2355 0.2596 0.5012 102.34 102.51 2.05
0.4988 0.2344 0.2596 0.4977 101.41
测定结果
0.5102 0.2398 0.2596 0.5113 104.59
Fig 7 VIP values of 11 common peaks of 10 batches 0.4993 0.2347 0.2596 0.5022 103.05
of the leaves of T. angulata from different re- 0.4987 0.2344 0.2596 0.4916 99.08
gions 0.5056 0.2376 0.2596 0.5092 104.61
异槲皮苷 0.5011 0.1052 0.1068 0.2074 95.69 99.16 2.58
液。精密吸取上述混合对照品溶液(0~4 号)和混合对 0.4988 0.1047 0.1068 0.2142 102.52
0.5102 0.1071 0.1068 0.2119 98.09
照品贮备液(5 号)各 10 μL,按照“2.1”项下色谱条件进 0.4993 0.1049 0.1068 0.2136 101.82
样测定,记录峰面积。以待测成分质量浓度为横坐标 0.4987 0.1047 0.1068 0.2103 98.85
(X)、对应峰面积为纵坐标(Y)作线性回归,得到金丝桃 0.5056 0.1062 0.1068 0.2109 98.06
苷、异槲皮苷的线性回归方程分别为 Y=8 103.7X+ 2.4.7 含量测定 分别称取 10 批样品粉末约 2 g,按照
27.906(r=0.999 7)、Y=54 478X-5.390 2(r=0.999 9), “2.2.2”项下方法制成供试品溶液后,再按照“2.1”项下色
其检测质量浓度的线性范围分别为0.003 42~0.136 90、 谱条件进样测定,记录峰面积并采用外标法分别计算样
0.000 99~0.039 60 mg/mL。 品中金丝桃苷、异槲皮苷的含量。每批样品重复测定 3
2.4.3 精密度试验 精密吸取“2.4.2”项下3号混合对照 次,取平均值。结果,10批样品中金丝桃苷、异槲皮苷的
品溶液,按照“2.1”项下色谱条件进样测定,连续进样 6 平均含量分别为0.47~6.97、0.21~1.87 mg/g,详见表6。
次,记录峰面积。结果,金丝桃苷、异槲皮苷峰面积的 表 6 10 批不同产地水冬瓜叶中金丝桃苷、异槲皮苷的
RSD 分别为 2.93%、1.42%(n=6),表明仪器精密度 含量测定结果(n=3)
良好。 Tab 6 Results of content determination of hyperoside
2.4.4 稳定性试验 取同一样品(编号 Y10)粉末 6 份, and isoquercitrin in 10 batches of T. angulata
每份 0.5 g,精密称定,按照“2.2.2”项下方法制成供试品 from different regions(n=3)
溶液,分别于室温下放置0、2、6、10、12、24 h时按照“2.1” 样品编号 金丝桃苷,mg/g 异槲皮苷,mg/g 样品编号 金丝桃苷,mg/g 异槲皮苷,mg/g
项下色谱条件进样测定,记录峰面积。结果,金丝桃苷、 Y1 0.47 0.21 Y6 6.97 1.77
Y2 3.84 0.67 Y7 6.75 1.87
异槲皮苷峰面积的 RSD 分别为 0.15%、2.35%(n=6), Y3 2.53 0.47 Y8 4.81 1.08
表明供试品溶液在室温下放置24 h内稳定。 Y4 0.77 0.27 Y9 2.13 0.81
2.4.5 重复性试验 取同一样品(编号 Y10)粉末共 6 Y5 5.44 1.34 Y10 5.28 1.07
份,每份0.5 g,精密称定,分别按照“2.2.2”项下方法制成 3 讨论
供试品溶液,再按照“2.1”项下色谱条件进样测定,记录 3.1 样品提取方法和提取溶剂考察
峰面积并根据外标法分别计算金丝桃苷、异槲皮苷的含 在前期预实验中,笔者分别考察了浸渍、超声、回流
量。结果,金丝桃苷、异槲皮苷含量的 RSD 分别为 等不同提取方法对样品HPLC指纹图谱的影响,同时考
2.82%、2.87%(n=6),表明该方法重复性较好。 察了水、10%~90%乙醇、无水乙醇以及不同体积分数
2.4.6 加样回收率试验 取同一批已知含量的样品(编 甲醇(10%~90%)等不同提取溶剂对样品 HPLC 指纹
号 Y1)粉末 0.5 g,共 6 份,分别置于具塞锥形瓶中,精密 图谱的影响。结果发现,以甲醇为提取溶剂且采用水浴
加入混合对照品贮备液(按“2.4.1”项下方法另配制金丝 回流提取时,样品的出峰最为丰富且峰形较好,故最终
桃苷、异槲皮苷质量浓度分别为 0.129 8、0.053 4 mg/mL 确定了本研究的提取溶剂与提取方法。
的混合对照品溶液)2 mL,再分别加入甲醇98 mL,其余 3.2 色谱条件的优化
按照“2.2.2”项下方法制成供试品溶液,然后按照“2.1”项 前期笔者采用二极管阵列检测器分别考察了样品
下色谱条件进样测定,记录峰面积。采用外标法分别计 在 210、220、230、240、250、260、270、280 nm 等不同波长
算样品中金丝桃苷、异槲皮苷的含量,并计算其加样回 下的响应效果。结果发现,在210 nm波长下,样品的出
收率。结果,金丝桃苷、异槲皮苷的平均加样回收率分 峰数量最多且响应普遍较强,故最终确定以210 nm作为
·1228 · China Pharmacy 2021 Vol. 32 No. 10 中国药房 2021年第32卷第10期