Page 58 - 《中国药房》2020年第24期
P. 58
r/min 离心 5 min,收集细胞沉淀,再用磷酸盐缓冲液 表 3 人参总皂苷对 PC12 衰老细胞周期分布的影响
(PBS,pH 7.2)漂洗2次,再按照FITC-Annexin Ⅴ凋亡检 (x±±s,n=3,,%%)
测细胞试剂盒说明书进行操作,使用流式细胞仪在激发 Tab 3 Effects of total ginsenosides on cell cycle distri-
波长488 nm处检测细胞凋亡情况并计算凋亡率:凋亡率 bution of PC12 senescent cells(x±±s,n=3,,%%)
=早期细胞凋亡率+晚期细胞凋亡率。结果,正常对照 组别 G1期细胞比例 S期细胞比例 G2期细胞比例
组、模型组和人参总皂苷低、高浓度组细胞的凋亡率分 正常对照组 32.53±0.94 34.47±0.80 13.80±1.53
模型组 39.75±1.10 ** 29.26±0.85 ** 15.78±1.05
别 为(15.85 ± 1.54)% 、(21.33 ± 1.06)% 、(12.76 ± 人参总皂苷低浓度组 35.50±0.75 ## 31.40±1.34 16.68±0.96
1.89)%、(11.15±2.48)%(n=3)。与正常对照组比较, 人参总皂苷高浓度组 36.49±0.82 ## 31.72±1.19 # 17.28±1.11
**
#
##
模型组细胞的凋亡率显著增加(P<0.05);与模型组比 注:与空白组比较, P<0.01;与模型组比较,P<0.05,P<0.01
#
##
**
较,人参总皂苷低、高浓度组细胞凋亡率均显著降低 Note:vs. blank group, P<0.01;vs. model group,P<0.05,P<
0.01
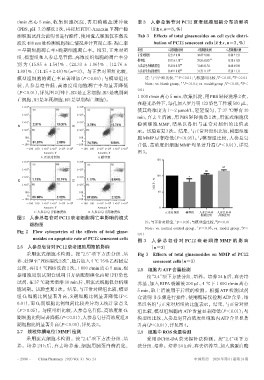
(P<0.01),详见图2(图中,R2是正常细胞,R3是晚期凋
1 000 r/min离心5 min,收集沉淀,用PBS轻轻洗涤2次,
亡细胞,R4是坏死细胞,R5是早期凋亡细胞)。
在避光条件下,每孔加入罗丹明123染色工作液500 μL,
1×10 6 1×10 6
使其终浓度为 1~2 μmol/L,轻轻混匀,于 37 ℃孵育 30
1×10 5 1×10 5
min,弃去上清液,用 PBS 轻轻洗涤 2 次,用流式细胞仪
1×10 4 1×10 4 检测细胞 MMP,结果以各组与正常对照组的比值表
PI PI
1×10 3 1×10 3 示。试验重复3次。结果,与正常对照组比较,模型组细
100 100 胞 MMP 显著降低(P<0.05);与模型组比较,人参总皂
0 0
-100 -100 苷低、高浓度组细胞 MMP 均显著升高(P<0.01),详见
-100 100 1×10 1×10 1×10 1×10 6 -100 100 1×10 1×10 1×10 1×10 6
5
4
3
4
3
5
Annexin Ⅴ Annexin Ⅴ 图3。
A.正常对照组 B.模型组
150
1×10 6 1×10 6
##
1×10 5 1×10 5
##
100
1×10 4 1×10 4 *
PI PI %
1×10 3 1×10 3 MMP,
100 100 50
0 0
-100 -100
5
5
4
3
4
-100 100 1×10 1×10 1×10 1×10 6 -100 100 1×10 1×10 1×10 1×10 6
3
Annexin Ⅴ Annexin Ⅴ 0
C.人参总皂苷低浓度组 D.人参总皂苷高浓度组 正常对照组 模型组 人参总皂苷 人参总皂苷
低浓度组 高浓度组
图 2 人参总皂苷对 PC12 衰老细胞凋亡率影响的流式
注:与正常对照组,P<0.05;与模型组比较,P<0.01
##
*
细胞图
#
Note:vs. normal control group, P<0.05;vs. model group,P<
*
Fig 2 Flow cytometries of the effects of total ginse-
0.01
nosides on apoptotic rate of PC12 senescent cells
图 3 人 参 总 皂 苷 对 PC12 衰 老 细 胞 MMP 的 影 响
2.6 人参总皂苷对PC12衰老细胞周期的影响 (n=3)
采用流式细胞术检测。按“2.5”项下方法分组、培 Fig 3 Effects of total ginsenosides on MMP of PC12
养、处理至“PBS漂洗2次”,随后加入4 ℃ 75%乙醇固定 senescent cells(n=3)
过夜,再用 4 ℃PBS 洗涤 2 次,1 000 r/min 离心 5 min,根 2.8 细胞内ATP含量检测
据细胞周期试剂盒说明书方法配制碘化丙啶(PI)染色 按“2.4”项下方法分组、培养。培养 24 h 后,弃去培
试剂,在37 ℃避光温浴30 min后,用流式细胞仪分析细 养基,加入 RIPA 裂解液 200 μL,4 ℃下 1 000 r/min 离心
胞周期。试验重复3次。结果,与正常对照组比较,模型 5 min,取上清液用于后续的检测。根据 ATP 检测试剂
组 G1细胞比例显著升高,S 期细胞比例显著降低(P< 盒说明书步骤进行操作,使用酶标仪检测 ATP 含量,结
0.01),而 G2期细胞比例组间比较差异均无统计学意义 果以各组与正常对照组的比值表示。结果,与正常对照
组比较,模型组细胞内ATP含量显著降低(P<0.01);与
(P>0.05)。与模型组比较,人参总皂苷低、高浓度组G1
期细胞比例显著降低(P<0.01),人参总皂苷高浓度组S 模型组比较,人参总皂苷高浓度组细胞内ATP含量显著
期细胞比例显著升高(P<0.05),详见表3。 升高(P<0.01),详见图4。
2.7 线粒体膜电位(MMP)检测 2.9 细胞中ROS含量检测
采用流式细胞术检测。按“2.4”项下方法分组、培 采用 DCFH-DA 荧光探针法检测。按“2.4”项下方
养。培养 24 h 后,弃去培养基,细胞用胰蛋白酶消化, 法分组、培养。培养24 h后,弃去培养基,加入胰蛋白酶
·2996 · China Pharmacy 2020 Vol. 31 No. 24 中国药房 2020年第31卷第24期