Page 75 - 2020年21期
P. 75
分析或 t 检验;P<0.05 为差异有统计学意义。结果,与 正常组样品
60 000 模型组样品
正常组小鼠比较,模型组小鼠WBC、NE、LY、MO计数均 QC样品
40 000
显著减少(P<0.01);与模型组比较,药物组小鼠上述血 20 000
常规指标均显著增加(P<0.01),详见表1。 t[2] 0
表 1 各组小鼠血常规指标水平比较(x±±s,n=8,×10 9 -20 000
-40 000
-1
L ) -60 000
Tab 1 Comparison of routine blood indexes of mice in -80 000 -50 000 0 50 000 100 000
-150 000
-1
each group(x±±s,n=8,×10 L ) t[1]
9
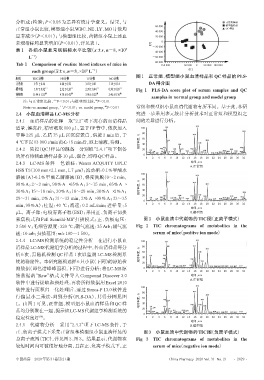
图 1 正常组、模型组小鼠血清样品和 QC 样品的 PLS-
组别 WBC计数 NE计数 LY计数 MO计数
正常组 9.71±0.46 4.88±0.50 3.41±0.41 1.14±0.14 DA得分图
模型组 5.97±0.82 ** 2.32±0.20 ** 2.70±0.44 ** 0.30±0.03 ** Fig 1 PLS-DA score plot of serum samples and QC
药物组 11.44±1.52 ## 4.70±0.42 ## 3.96±0.25 ## 2.46±0.36 ##
samples in normal group and model group
##
**
注:与正常组比较, P<0.01;与模型组比较,P<0.01
##
**
Note:vs. normal group, P<0.01;vs. model group,P<0.01 常组和模型组小鼠血清代谢物有所不同。基于此,本研
2.4 小鼠血清样品LC-MS分析 究进一步采用多元统计分析技术对正常组和模型组之
2.4.1 血清样品的处理 取“2.2”项下冻存的血清样品 间的差异进行分析。
适量,解冻后,精密吸取100 μL,置于EP管中,依次加入 100
甲醇 225 μL、乙腈 75 μL 以沉淀蛋白,涡旋 2 min 后,于 % 80
4 ℃下以13 000 r/min离心15 min后,取上清液,待测。 相对丰度, 60
40
2.4.2 质控(QC)样品的制备 分别取“2.4.1”项下制备 20
的所有待测血清样品各10 μL,混合,即得QC样品。 0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
2.4.3 LC-MS 条件 色谱柱:Waters ACQUITY UPLC 时间,min
A.正常组
HSS T3(100 mm×2.1 mm,1.7 μm);流动相:0.1%甲酸水
100
溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱(0~2 min, 80
%
98%A;2~3 min,98%A→65%A;3~15 min,65%A→ 60
30%A;15~18 min,30%A;18~29 min,30%A→2%A; 相对丰度, 40
29~31 min,2%A;31~33 min,2%A→98%A;33~35 20
0
min,98%A);柱温:40 ℃;流速:0.2 mL/min;进样量:5 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
时间,min
μL。离子源:电喷雾离子源(ESI);采用正、负离子切换 B.模型组
采集模式和 Full Scan/dd-MS 扫描模式;正、负极电压: 图2 小鼠血清中代谢物的TIC图(正离子模式)
2
3 500 V;毛细管温度:320 ℃;鞘气流速:35 Arb;辅气流 Fig 2 TIC chromatograms of metabolites in the
速:10 arb;扫描范围:m/z 100~1 500。 serum of mice(positive ion mode)
2.4.4 LC-MS 检测系统的稳定性分析 在进行小鼠血 100
清样品LC-MS代谢组学分析的过程中,各血清样品每分 % 80
析 6 次,需随机检测 QC 样品 1 次以监测 LC-MS 检测系 相对丰度, 60
40
统的稳定性。本研究随机选择6只小鼠(下同)的原始检 20
测数据(即色谱峰峰面积,下同)进行分析:将LC-MS原 0
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
始数据的“Raw”格式文件导入 Compound Discover 3.0 时间,min
A.正常组
软件中进行提取和预处理,再将所得数据用 Excel 2010
100
软件进行面积归一化处理后,通过 Simca-P 13.0 软件进 80
行偏最小二乘法-判别分析(PLS-DA),其得分图见图 % 60
1。由图 1 可见,正常组、模型组小鼠血清样品和 QC 样 相对丰度, 40
品均分别聚在一起,提示该LC-MS代谢组学检测系统的 20
0
稳定性良好 。 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32
[18]
时间,min
2.4.5 代谢物分析 采用“2.4.3”项下 LC-MS 条件,于 B.模型组
正、负离子模式下采集正常组和模型组小鼠血清样品的 图3 小鼠血清中代谢物的TIC图(负离子模式)
总离子流图(TIC),详见图2、图3。结果显示,代谢物在 Fig 3 TIC chromatograms of metabolites in the
较短时间内可被很好地分离,且在正、负离子模式下,正 serum of mice(negative ion mode)
中国药房 2020年第31卷第21期 China Pharmacy 2020 Vol. 31 No. 21 ·2629 ·