Page 22 - 202013
P. 22
5 000 个/孔接种于 24 孔超低黏附板中,每组设置 3 个复 度值的比值表示目的蛋白的表达水平。试验重复3次。
孔。每孔中加入2 mL悬浮成球试验培养基(含5 μg/mL 2.8 U0126抑制ERK蛋白表达后对E2转化细胞克隆形
胰 岛 素 、2% B-27 添 加 物 、20 ng/mL EGF、20 ng/mL 成能力、自我更新能力以及干性标志物表达的影响
FGFB、1 μg/mL 氢化可的松和 1%青链霉素的 DMEM/ 取对数生长期的 E2转化细胞,随机分为对照组(含
F12 培养基),在培养箱中培养 10 d 后,于显微镜下拍照 0.1%DMSO)和 U0126(ERK 抑制剂)组(10 μmol/L)。
并对每组的成球情况进行计数。试验重复3次。 分别按“2.4”项下方法检测细胞的克隆形成能力,按
2.6 实 时 荧 光 定 量 -PCR 试 验 检 测 细 胞 中 CD44、 “2.5”项下方法检测细胞自我更新能力,按“2.7”项下方
Nanog、OCT4、ERK mRNA的表达情况 法检测细胞中 CD44、Nanog、OCT4 和 p-ERK 蛋白的表
取“2.2”项下 3 组对数生长期细胞,分别按 2×10 5 达情况(以α-tubulin 为内参,稀释比例为 1 ∶ 10 000)。试
个/孔接种于6孔板中,每组设置2个复孔。待细胞贴壁 验均重复3次。
后,以 DMEM/F12 培养基(不含血清)于培养箱中培养 2.9 统计学方法
48 h。按照 Trizol 说明书方法操作,分离提取细胞中的 采用 SPSS 11.5 软件对数据进行统计处理和分析。
总 RNA,用超微量分光光度计测定各组 RNA 浓度。使 数据以x±s表示。多组间比较采用单因素方差分析,两
用 PrimeScript TM RT reagent Kit 试剂盒并按说明书方法 独立样本组间比较采用 t 检验。P<0.05 表示差异具有
操作,将 1 μg 总 RNA 逆转录为 cDNA,并以 cDNA 为模 统计学意义。
板进行PCR扩增。反应体系:cDNA模板2 μL,上、下游 3 结果
引物各0.8 μL,SYBR Premix Ex Taq TM Ⅱ 10.4 μL、无酶 3.1 Calpeptin对E2转化细胞形态学特征的影响
®
水 6 μL,总体系为 20 μL。反应条件:95 ℃预变性 30 s; 细胞形态学观察发现,与对照组比较,E2转化组细
95 ℃变性3 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循 胞形态发生了明显变化,细胞呈长梭形贴壁生长,细胞
环。以GAPDH为内参,采用2 -ΔΔc t 法计算CD44、Nanog、 体积变大,具有一定的间质细胞样特征;E2 转化+Cal-
OCT4 和 ERK mRNA 的表达水平(其中 ct表示每个反应
peptin组细胞形态与对照组接近。各组细胞形态学特征
管内的荧光信号达到设定阈值时所经历的循环次数)。 显微图见图1。
试验重复3次。引物序列及扩增产物长度见表1。
表1 引物序列及扩增产物长度
Tab 1 Primer sequence and the length of amplified
products
引物名称 上游(5′→3′) 下游(5′→3′) 产物长度,bp
CD44 CTGCCGCTTTGCAGGTGTA CATTGTGGGCAAGGTGCTATT 109
Nanog TTTGTGGGCCTGAAGAAAACT AGGGCTGTCCTGAATAAGCAG 116
OCT4 GTGTTCAGCCAAAAGACCATCT GGCCTGCATGAGGGTTTCT 119 A. 对照组 B. E2转化组
ERK CTCAAGCCTTCCAACCTC TTCCACGGCACCTTATTT 180
GAPDH GGAGCGAGATCCCTCCAAAAT GGCTGTTGTCATACTTCTCATGG 197
2.7 Western bloting 试验检测细胞中 CD44、Nanog、
OCT4、ERK和p-ERK蛋白的表达情况
取“2.2”项下3组对数生长期细胞,分别按“2.6”项下
方法进行细胞接种、培养,然后以RIPA蛋白裂解液提取
C. E2转化+Calpeptin组
总蛋白,再以BCA法进行蛋白定量后进行制样。蛋白样
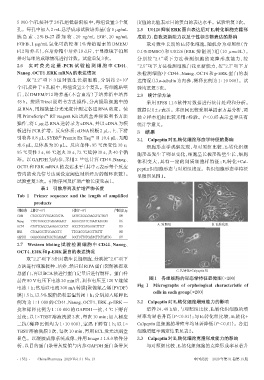
图1 各组细胞的形态学特征显微图(×200)
品在80 V电压下电泳30 min后,调节电压至120 V继续
Fig 1 Micrographs of orphological characteristic of
电泳 1 h;然后以电流 300 mA 转膜[聚偏氟乙烯(PVDF)
cells in each group(×200)
膜]1.5 h,以5%脱脂奶粉室温封闭1 h;分别加入稀释比
例均为 1 ∶ 1 000 的 CD44、Nanog、OCT4、ERK、p-ERK 一 3.2 Calpeptin对E2转化细胞增殖能力的影响
抗和稀释比例为 1 ∶ 10 000 的 GAPDH 一抗,4 ℃下孵育 培养24、48 h后,与对照组比较,E2转化组细胞的增
过夜;以 1×TBST 溶液洗膜 3 次,每次 10 min;加入相应 殖率均显著升高(P<0.01);与 E2转化组比较,E2转化+
二抗(稀释比例均为 1 ∶ 10 000),室温下孵育 1 h;以 1× Calpeptin 组细胞的增殖率均显著降低(P<0.01)。各组
TBST溶液洗膜3次,每次10 min,再用ECL发光试剂盒 细胞增殖率测定结果见表2。
显色。以凝胶成像系统成像,并用 Image J 1.8.0 软件分 3.3 Calpeptin对E2转化细胞克隆形成能力的影响
析,以目的蛋白条带灰度值与内参 GAPDH 蛋白条带灰 与对照组比较,E2转化组细胞的克隆形成率显著升
·1552 · China Pharmacy 2020 Vol. 31 No. 13 中国药房 2020年第31卷第13期