Page 54 - 202012
P. 54
μg/mL)质控样品溶液(含醇量为1%),每质量浓度平行 百分比低至约(85.63±1.55)%,之后随着时间延长,剩
5 份,分别按“2.4.4”“2.4.5”项下方法处理,再按“2.1”项 余百分比无明显变化;在人工胃液中的剩余百分比从 0
下色谱条件进样分析,记录峰面积,按标准曲线法计算 h 的(94.94±3.52)%下降至 6.0 h 的(16.19±1.17)%,详
Gedatolisib含量,以测得值与真实值进行比较,考察准确 见表3。
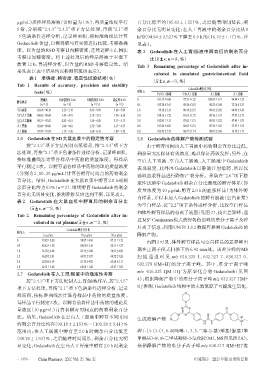
度。以含量的RSD考察日内精密度;连续进样3 d,同法 表 3 Gedatolisib 在人工胃/肠液中孵育后的剩余百分
考察日间精密度。将上述处理后的样品溶液于室温下 比(x±±s,n=3,%%)
放置 12 h,再进样分析,以含量的 RSD 考察稳定性。结 Tab 3 Remaining percentage of Gedatolisib after in-
果见表1(表中结果均以检测值范围表示)。
cubated in simulated gastric/intestinal fluid
表1 准确度、精密度、稳定性试验结果(%%)
(x±±s,n=3,%%)
Tab 1 Results of accuracy,precision and stability
Gedatolisib剩余百分比
tests(%%) 时间,h 空白人工肠液 空白人工胃液 人工肠液 人工胃液
准确度 日内精密度RSD 日间精密度RSD 稳定性RSD 0 101.35±0.86 97.33±1.22 100.03±1.31 94.94±3.52
孵育体系
(n =5) (n =5) (n =15) (n =5) 0.5 103.20±3.41 89.38±3.53 90.32±3.44 72.76±2.37
空白血浆 82.64~90.36 3.25~5.39 4.63~9.89 5.66~7.89 1.0 99.18±2.15 88.74±2.15 89.81±2.02 60.05±4.10
空白人工胃液 84.02~90.64 1.43~4.91 2.12~5.12 1.56~6.20 2.0 100.16±1.52 85.63±1.55 88.76±1.53 57.47±2.75
空白人工肠液 89.21~92.63 0.82~4.15 1.54~4.43 3.11~5.17 3.0 102.85±3.13 87.62±3.71 89.83±2.32 47.49±1.87
人工胃液 82.86~90.06 1.84~4.01 2.32~7.84 2.13~6.73 4.0 101.64±4.83 86.83±2.33 87.76±1.85 37.53±1.95
人工肠液 87.97~91.07 1.17~3.36 1.68~6.36 1.89~3.32 6.0 102.43±2.73 86.91±1.14 88.01±2.68 16.19±1.17
2.6 Gedatolisib在SD大鼠血浆中的稳定性考察 2.8 Gedatolisib的降解产物检测试验
按“2.4.2”项下方法配制血浆样品,按“2.4.4”项下方 由于孵育时间内人工胃液中药物剩余百分比过低,
法处理,再按“2.1”项下色谱条件进样分析,记录峰面积, 剩余量无法保证有效浓度,难以保证药效发挥;另外,在
按标准曲线法计算各样品中药物的质量浓度。每样品 空白人工胃液、空白人工肠液、人工肠液中 Gedatolisib
平行测定3次。以孵育前各样品中药物的理论质量浓度 表现稳定,此外因 Gedatolisib 以静脉注射给药,所以仅
(分别为2、10、30 μg/mL)计算各孵育时间点的药物剩余 选取血浆样品进行降解产物分析。采集在“2.6”项下稳
百分比。结果,Gedatolisib在大鼠血浆中孵育2.0 h时剩
定性试验中Gedatolisib剩余百分比最低的孵育体系(即
余百分比约为63%(n=3),继续孵育Gedatolisib的剩余
质量浓度为 10 μg/mL 孵育 2.0 h 的血浆样品)为体外孵
百分比无明显变化,推测降解反应达到平衡,详见表2。
育样品,并以未加入Gedatolisib的孵育溶液(空白血浆)
表 2 Gedatolisib 在大鼠血浆中孵育后的剩余百分比
为空白样品,按“2.2”项下条件进样分析,比较空白样品
(x±±s,n=3,%%)
和体外孵育样品的总离子流图(见图3),找出差异峰;通
Tab 2 Remaining percentage of Gedatolisib after in-
过MS Continuum模式获得各色谱峰的准分子离子及碎
E
cubated in rat plasma(x±±s,n=3,%%)
片离子信息;利用UNIFI 1.8.2数据库推测Gedatolisib的
Gedatolisib剩余百分比
时间,h
2 μg/mL 10 μg/mL 30 μg/mL 降解产物。
0 99.82±0.20 98.87±4.69 97.13±3.32 由图 3 可见,体外孵育样品与空白样品的差异峰出
0.5 88.42±1.50 100.92±2.61 88.31±1.27
1.0 76.70±6.24 83.15±2.40 76.91±4.83 现在正离子模式扫描下的6.42 min处。该差异峰的MS
1.5 66.20±1.81 66.85±5.87 64.52±3.26 扫 描 通 道 可 见 m/z 616.335 1、632.327 7、630.317 0、
2.0 62.20±5.14 63.72±4.02 62.65±2.11 602.278 6[M+H] 的分子离子峰。其中,准分子离子峰
+
3.0 62.51±3.68 64.60±1.42 62.27±3.05
+
m/z 616.335 1[M+H] 为原型化合物 Gedatolisib(见图
2.7 Gedatolisib在人工胃/肠液中的稳定性考察
4);根据降解产物中的准分子离子峰 m/z 632.327 7[M+
按“2.4.3”项下方法配制人工胃/肠液样品,按“2.4.5”
+
项下方法处理,再按“2.1”项下色谱条件进样分析,记录 H] 推测,Gedatolisib结构中的末端氮原子可能发生氧化,
峰面积,按标准曲线法计算各样品中药物的质量浓度。
每样品平行测定3次。以孵育前各样品中药物的理论质
量浓度(10 μg/mL)计算各孵育时间点的药物剩余百分
比。结果,Gedatolisib 在空白人工肠液中孵育不同时间 生成降解产物 ,
的剩余百分比均在(99.18±2.15)%~(103.20±3.41)%
范围内;在人工肠液中孵育至 2.0 h 时剩余百分比低至 即1-(4-(3-(4,6-双吗啉-1,3,5-三嗪-2-基)苯基)脲基)苯
(88.76±1.53)%,之后随着时间延长,剩余百分比无明 甲酰基)-N,N-二甲基哌啶-4-氧化胺(M1,MS图见图5A);
+
显变化;Gedatolisib在空白人工胃液中孵育2.0 h时剩余 根据降解产物的准分子离子峰 m/z 630.317 0[M+H] 推
·1456 · China Pharmacy 2020 Vol. 31 No. 12 中国药房 2020年第31卷第12期