Page 60 - 《中国药房》2024年19期
P. 60
道菌群α多样性分析,通过主成分分析(principal compo‐ 厚度等正态分布数据(以 x±s 表示)采用单因素方差分
nent analysis,PCA)和主坐标分析(principal co-ordinates 析;对 16S rDNA 测序中 PCA 和 PCoA 分析等非正态分
analysis,PCoA)进行肠道菌群 β 多样性分析,同时对肠 布数据采用非参数多元方差分析进行组间差异比较。
道菌群门属水平进行分析。 检验水准α=0.05。
2.4 大鼠粪便中SCFA含量测定 3 结果
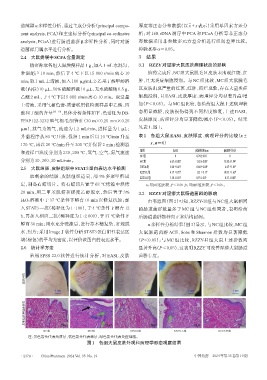
精密称取各组大鼠粪便样品1 g,加入1 mL水混匀, 3.1 RZZY对湿疹大鼠皮肤病理状态的影响
常温超声 10 min,然后于 4 ℃下以 15 000 r/min 离心 10 给药完成后,NC组大鼠脱毛区皮肤未出现红斑、红
min;取1 mL上清液,加入100 μg/mL 2-乙基丁酸甲醇溶 肿,且无炎症细胞浸润。与NC组比较,MC组大鼠脱毛
液(内标)10 μL、50%硫酸溶液10 μL、无水硫酸钠0.5 g、 区皮肤出现严重的红斑、红肿、溃烂现象,存在大量炎症
乙醚2 mL,于4 ℃下以5 000 r/min离心10 min。取适量 细胞浸润,且 EASI、皮肤厚度、病理评分均显著升高/增
上清液,采用气相色谱-质谱联用仪检测样品中乙酸、丙 加(P<0.05)。与MC组比较,各给药组大鼠上述病理状
酸和丁酸的含量 [12―13] ,具体分析条件如下:色谱柱为DB- 态明显减轻,皮肤损伤得到不同程度修复,上述 EASI、
FFAP122-3232 型气相毛细管柱(30 m×0.25 mm×0.25 皮肤厚度、病理评分均显著降低/减小(P<0.05)。结果
μm),载气为氮气,流速为 1.2 mL/min,进样量为 1 μL; 见表1、图1。
升温程序从 80 ℃开始,保留 1 min 后以 10 ℃/min 升至 表1 各组大鼠 EASI、皮肤厚度、病理评分的比较(x±
170 ℃,再以20 ℃/min升至200 ℃并保留2 min;检测器 s,n=6)
和进样口温度分别为230、200 ℃,氢气、空气、氮气流速 组别 EASI 皮肤厚度/mm 病理评分/分
NC组 0 0.74±0.07 0
分别为30、300、30 mL/min。 MC组 6.67±0.82 a 1.62±0.08 a 15.83±1.94 a
2.5 大鼠结肠、皮肤组织中STAT3蛋白表达水平检测 DEXA组 3.00±0.63 b 0.84±0.04 b 6.67±1.03 b
RZZY-L组 4.17±0.75 b 1.21±0.11 b 10.83±1.60 b
取剩余的结肠、皮肤组织适量,用 4% 多聚甲醛固 RZZY-H组 3.50±0.55 b 0.93±0.0 b 8.33±0.82 b
定,制备石蜡切片。将石蜡切片置于 68 ℃烤箱中烘烤 a:与NC组比较,P<0.05;b:与MC组比较,P<0.05。
20 min,用二甲苯脱蜡和梯度乙醇脱水,然后置于 3% 3.2 RZZY对湿疹大鼠肠道菌群的影响
H2O2溶液中于 37 ℃条件下孵育 10 min 以修复抗原;加 由韦恩图(图2)可知,RZZY-H组与NC组大鼠相同
入 STAT3 一抗(稀释度为 1∶100),于 4 ℃条件下孵育 12 的肠道菌群数量多于 MC 组与 NC 组相同者,表明给药
h,再加入相应二抗(稀释度为1∶2 000),于37 ℃条件下 后肠道菌群物种向正常结构回调。
孵育30 min;用水充分洗涤后,进行苏木精复染、常规脱 α多样性分析结果(图3)显示,与NC组比较,MC组
水、封片;采用ImageJ软件分析STAT3蛋白阳性表达区 大鼠肠道菌群 ACE、Sobs 和 Shannon 指数均显著降低
域(棕色)的平均光密度,以评价该蛋白的表达水平。 (P<0.05);与 MC 组比较,RZZY-H 组大鼠上述指数均
2.6 统计学方法 显著升高(P<0.05),这表明RZZY可改善湿疹大鼠肠道
采用 SPSS 22.0 软件进行统计分析,对 EASI、皮肤 菌群丰度。
皮肤外观
皮肤组织病理学形态
NC组 100 μm MC组 100 μm DEXA组 100 μm RZZY-L组 100 μm RZZY-H组 100 μm
注:黑色箭头代表角质层,蓝色箭头代表棘层,绿色箭头代表炎症细胞。
图1 各组大鼠皮肤外观和病理学形态观察结果
· 2374 · China Pharmacy 2024 Vol. 35 No. 19 中国药房 2024年第35卷第19期