Page 63 - 《中国药房》2023年14期
P. 63
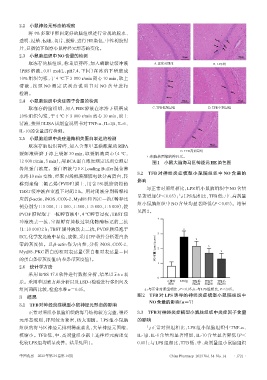
2.2 小鼠神经元形态的观察
将 4% 多聚甲醛固定好的脑组织进行常规的脱水、
透明、浸蜡、包埋、切片、脱蜡,进行HE染色,中性树胶封
片,显微镜下观察小鼠神经元形态的变化。
2.3 小鼠脑组织中NO含量的检测
取冻存的脑组织,称重后剪碎,加入磷酸盐缓冲液 A.正常对照组 B. LPS组
(PBS 溶液,0.01 mol/L,pH7.4,下同)在冰浴下研磨成
10% 组织匀浆,于 4 ℃下 3 000 r/min 离心 10 min,取上
清 液 ,按 照 NO 测 定 试 剂 盒 说 明 书 对 NO 含 量 进 行
检测。
2.4 小鼠脑组织中炎症因子含量的检测
取冻存的脑组织,加入 PBS 溶液在冰浴下研磨成 C. TFB低剂量组 D. TFB中剂量组
10% 组织匀浆,于 4 ℃下 3 000 r/min 离心 10 min,取上
清液,按照 ELISA 试剂盒说明书对 TNF-α、IL-1β、IL-6、
IL-10的含量进行检测。
2.5 小鼠脑组织中炎症通路相关蛋白表达的检测
取冻存脑组织剪碎,加入含苯甲基磺酰氟的 RIPA
E. TFB高剂量组
裂解液研磨于冰上裂解 30 min,取裂解液离心(4 ℃,
→:细胞核固缩的神经元。
12 000 r/min,5 min),用 BCA 蛋白浓度测定试剂盒测定 图1 小鼠大脑海马区神经元HE染色图
各组蛋白浓度。蛋白溶液与 5×Loading Buffer 混合沸
3.2 TFB 对神经炎症模型小鼠脑组织中 NO 含量的
水浴 10 min 变性,经聚丙烯酰胺凝胶电泳分离蛋白,转
影响
移到聚偏二氟乙烯(PVDF)膜上,用含 5% 脱脂奶粉的
与正常对照组相比,LPS 组小鼠脑组织中 NO 含量
TBST 缓冲液在室温下封闭 2 h。用封闭液分别稀释相
显著增加(P<0.05);与 LPS 组相比,TFB 低、中、高剂量
应的 β-actin、iNOS、COX-2、Myd88 和 PKC 一抗(稀释比
组小鼠脑组织中 NO 含量均显著降低(P<0.05)。结果
例分别为1∶5 000、1∶1 000、1∶500、1∶5 000、1∶5 000),使
见图2。
PVDF 膜浸泡于一抗孵育液中,4 ℃孵育过夜;TBST 缓
4
冲液洗去一抗,室温孵育辣根过氧化物酶标记的二抗
(1∶10 000)2 h;TBST 缓冲液洗去二抗,PVDF 膜浸泡于 a
ECL化学发光液中显色,成像,采用IPP软件分析蛋白条 b
带的灰度值。以 β-actin 作为内参,分析 iNOS、COX-2、 ( μmol/g prot ) 3 b
Myd88、PKC 蛋白的相对表达量(蛋白相对表达量=目 2 b
的蛋白条带灰度值/内参条带灰度值)。 NO含量/
1
2.6 统计学方法
采用 SPSS 17.0 软件进行数据分析,结果以 x±s 表
0
示。采用单因素方差分析以及LSD-t检验进行多组间及 正常对 LPS组 TFB低 TFB中 TFB高
照组 剂量组 剂量组 剂量组
组间两两比较,检验水准α=0.05。 a:与正常对照组相比,P<0.05;b:与LPS组相比,P<0.05。
3 结果 图2 TFB 对 LPS 诱导的神经炎症模型小鼠脑组织中
NO含量的影响(n=7)
3.1 TFB对神经炎症模型小鼠神经元形态的影响
正常对照组小鼠脑组织的海马结构较为完整,神经 3.3 TFB对神经炎症模型小鼠脑组织中炎症因子含量
元形态规则,排列较为紧密,核大而圆。LPS 组小鼠脑 的影响
组织的海马区神经元排列稀疏紊乱,大量神经元固缩, 与正常对照组相比,LPS 组小鼠脑组织中 TNF-α、
核缩小。TFB 低、中、高剂量组小鼠上述神经元病理变 IL-1β、IL-6 含量均显著增加,IL-10 含量显著降低(P<
化较LPS组均明显改善。结果见图1。 0.05);与 LPS 组相比,TFB 低、中、高剂量组小鼠脑组织
中国药房 2023年第34卷第14期 China Pharmacy 2023 Vol. 34 No. 14 · 1721 ·