Page 64 - 《中国药房》2023年14期
P. 64
中 TNF-α、IL-1β、IL-6 含量均显著降低,IL-10 含量均显 LPS 作为一种细菌内毒素,经腹腔注射后,诱导小胶质
著增加(P<0.05)。结果见图3。 细胞向 M1 表型活化,增加炎症介质如 TNF-α、IL-1β、
5 000 IL-6 释放,减少抗炎介质如IL-10分泌,加重神经炎症反
a TNF-α
IL-1β [11―12]
4 000 应,损伤神经元 。本研究结果发现,腹腔注射 LPS
IL-6
b
IL-10
( pg/g ) 3 000 a b 后,小鼠海马神经元排列紊乱、大量神经元固缩,核缩
含量/ 2 000 a b b b 小,促炎因子 TNF-α、IL-1β 及 IL-6 含量明显上升,抗炎
b b b b b
1 000 b b 因子 IL-10 含量明显下降,表明腹腔注射 LPS 可诱导小
a
鼠产生神经炎症反应,神经炎症模型制备成功;TFB 预
0
正常对 LPS组 TFB低剂 TFB中剂 TFB高剂
照组 量组 量组 量组 防性给药能够改善LPS引起的神经元损伤,显著降低促
a:与正常对照组相比,P<0.05;b:与LPS组相比,P<0.05。 炎因子 TNF-α、IL-1β 及 IL-6 含量,升高抗炎因子 IL-10
图3 TFB对LPS诱导的神经炎症模型小鼠脑组织中炎
含量,提示TFB具有改善神经炎症反应的药理活性。
症因子含量的影响(n=7)
iNOS 和 COX-2 分别是 NO 的合成酶和催化花生四
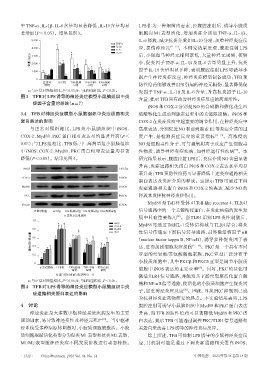
3.4 TFB对神经炎症模型小鼠脑组织中炎症通路相关 烯酸转化生成前列腺素过程中的关键限速酶。iNOS和
蛋白表达的影响 COX-2在炎症反应中起重要的调节作用,在神经炎症中
与正常对照组相比,LPS 组小鼠脑组织中 iNOS、 高度表达,分别促进NO和前列腺素E2等炎症介质的过
COX-2、Myd88、PKC 蛋白相对表达量均显著升高(P< 度产生,是检测炎症反应的重要指标 [13―14] 。高浓度的
0.05);与 LPS 组相比,TFB 低、中、高剂量组小鼠脑组织 NO 是细胞毒性分子,可与超氧阴离子反应产生细胞毒
中 iNOS、COX-2、Myd88、PKC 蛋白相对表达量均显著 性物质,诱导神经炎症疾病,如神经退行性疾病 。本
[15]
降低(P<0.05)。结果见图4。 研究结果显示,腹腔注射LPS后,炎症介质NO含量显著
升高,炎症通路相关蛋白 iNOS 和 COX-2 表达水平均显
iNOS 130 kDa
著升高;TFB预防性给药可显著降低上述炎症通路相关
COX-2 70 kDa
蛋白表达及炎症介质的释放。这提示 TFB 可通过下调
Myd88 38 kDa
炎症通路相关蛋白 iNOS 和 COX-2 的表达,减少 NO 的
PKC 84 kDa 释放来发挥抗神经炎症作用。
Myd88 是 Toll 样受体 4(Toll-like receptor 4,TLR4)
β-actin 42 kDa
正常对照组 LPS组 TFB低剂量组 TFB中剂量组 TFB高剂量组 信号通路中的一个关键衔接蛋白,在炎症疾病的发生发
A.蛋白表达电泳图 展中具有重要作用 。当 TLR4 识别 LPS 炎性刺激后,
[16]
1.0
a a iNOS
a Myd88 可通过 Toll/IL-1 受体结构域与 TLR4 结合,将炎
COX-2
0.8 Myd88
b PKC 性信号传递至下游信号转导通路,最终激活核因子 κB
蛋白相对表达量 0.6 b b b b b b b (nuclear factor kappa B,NF-κB),诱导多种促炎因子表
b
a
b
达,进而加剧细胞炎症损伤
。PKC是一个具有不同
[17―18]
0.4
0.2 b b 亚型的丝氨酸/苏氨酸激酶家族,PKC 亚型广泛分布于
小胶质细胞中,其中 PKCβ 和 PKCδ 亚型是调节小胶质
0
正常对照组 LPS组 TFB低剂 TFB中剂 TFB高剂 细胞中 iNOS 表达的主要亚型 。同时,PKC 的活化可
[19]
量组 量组 量组
B.蛋白相对表达量柱状图(n=3)
激活 TLR4 信号通路,并触发其下游丝裂原活化蛋白激
a:与正常对照组相比,P<0.05;b:与LPS组相比,P<0.05。 酶和NF-κB信号通路,使活化的小胶质细胞产生促炎因
图4 TFB对LPS诱导的神经炎症模型小鼠脑组织中炎
子,加重神经炎症反应 。因此,寻找 PKC 抑制剂已成
[20]
症通路相关蛋白表达的影响
为抗神经炎症药物研究的热点。本实验结果表明,LPS
4 讨论 腹腔注射可诱导小鼠脑组织中Myd88和PKC 蛋白表达
神经炎症是大多数中枢神经系统疾病发生的主要 升高,而 TFB 预防性给药可显著降低 Myd88 和 PKC 蛋
[10]
驱动因素,易导致神经变性及神经元死亡 。当中枢神 白表达,提示TFB可能通过调控PKC/TLR4信号通路相
经系统受多种病原体刺激时,小胶质细胞被激活。小胶 关蛋白来改善LPS诱导的神经炎症反应。
质细胞根据活化类型分为促炎M1表型和抗炎M2表型, 综上所述,TFB可抑制LPS诱导的小鼠神经炎症反
M1/M2 表型随神经炎症不同发展阶段进行动态转换。 应,其机制可能是通过下调炎症通路相关蛋白 iNOS、
· 1722 · China Pharmacy 2023 Vol. 34 No. 14 中国药房 2023年第34卷第14期