Page 67 - 2020年2月第31卷第3期
P. 67
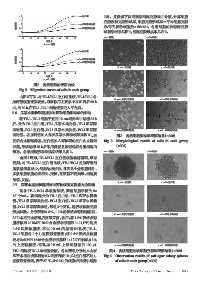
2.0 TE-1空白组 2 周。显微镜下肉眼观察细胞克隆球并计数,计算细胞
1.5 克隆数和克隆形成率,细胞克隆形成率=平均细胞克隆
细胞指数 1.0 TE-1瓜蒂水提物组 数/每孔接种细胞数×100% 。各组细胞的软琼脂克隆
[8]
0.5
TE-1瓜蒂醇提物组
0 球观察结果见图4,细胞克隆形成率见表2。
-0.5
0 10 20 30 40 50 60 70 TE-1细胞: EC-1细胞:
时间,h
A. TE-1细胞
2.0
EC-1空白组
1.5
细胞指数 1.0 EC-1瓜蒂水提物组
EC-1瓜蒂醇提物组
0.5
0
A. TE-1空白组 B. EC-1空白组
-0.5
0 10 20 30 40 50 60 70
时间,h
B. EC-1细胞
图2 各组细胞的迁移曲线
Fig 2 Migration curves of cells in each group
由图2可知,与TE-1/EC-1空白组比较,TE-1/EC-1各
C. TE-1瓜蒂水提物组 D. EC-1瓜蒂水提物组
加药组细胞迁移缓慢,抑制作用主要集中在加药后 60 h
内,约60 h后TE-1、EC-1细胞迁移进入平台期。
2.6 瓜蒂水提物和醇提物对两种细胞形态学的影响
将TE-1、EC-1细胞于直径10 cm培养皿中培养24 h
后,分为 TE-1 空白组、TE-1 瓜蒂水提物组、TE-1 瓜蒂醇
提物组、EC-1 空白组、EC-1 瓜蒂水提物组、EC-1 瓜蒂醇 E. TE-1瓜蒂醇提物组 F. EC-1瓜蒂醇提物组
提物组。各加药组加入含有瓜蒂水提物或醇提物IC50浓 图3 各组细胞形态学观察结果(×200)
度的含血清培养基,空白组加入等体积的空白含血清培 Fig 3 Morphological results of cells in each group
养基,继续培养48 h后采用倒置显微镜观察各组细胞的 (×200)
形态。各组细胞形态学观察结果见图3。 TE-1细胞: EC-1细胞:
由图 3 可知,TE-1/EC-1 空白组细胞轮廓清晰,形态
规则;与 TE-1/EC-1 空白组比较,TE-1/EC-1 各加药组细
胞数量明显减少,细胞结构松散,且可见少量细胞碎片,
多数细胞细胞轮廓消失、变圆,甚至呈不规则形,细胞膜
皱缩、发泡。
A. TE-1空白组 B. EC-1空白组
2.7 瓜蒂水提物和醇提物对两种细胞克隆能力的影响
制备 TE-1、EC-1 单细胞悬液,调整细胞浓度为 8×
3
10 个/mL。将细胞分为 TE-1 空白组、TE-1 瓜蒂水提物
组、TE-1 瓜蒂醇提物组、EC-1 空白组、EC-1 瓜蒂水提物
组、EC-1瓜蒂醇提物组,每组3个复孔,进行软琼脂克隆
形成试验。分别配制0.6%、1.2%的低熔点琼脂糖溶液,
C. TE-1瓜蒂水提物组 D. EC-1瓜蒂水提物组
80℃水浴完全溶解后高压灭菌,备用;将1.2%低熔点琼
脂溶液与 2×RMPI 1640 含血清培养基以 1 ∶ 1(V/V)制成
0.6%底层琼脂液,再以 0.8 mL/孔铺满 24 孔板(TE-1、
EC-1 细胞各 1 个),室温静置凝固;将 0.6%低熔点琼脂
液与2×RMPI 1640含血清培养基以1 ∶ 1(V/V)制成0.3%
的上层琼脂液,每孔加 0.8 mL 上层琼脂液和 100 μL E. TE-1瓜蒂醇提物组 F. EC-1瓜蒂醇提物组
TE-1细胞或EC-1单细胞悬液。各加药组分别加入含有 图4 各组细胞的软琼脂克隆球观察结果(×200)
瓜蒂水提物或醇提物IC50浓度药液10 μL(空白组不加), Fig 4 Observation results of soft agar colony spheres
室温静置凝固,再于37 ℃、5%CO2的细胞培养箱中培养 of cells in each group(×200)
中国药房 2020年第31卷第3期 China Pharmacy 2020 Vol. 31 No. 3 ·317 ·