Page 65 - 《中国药房》2025年4期
P. 65
固定20 min,以磷酸盐缓冲液洗涤3次,最后用结晶紫染 3 结果
色10 min。使用显微镜观察细胞侵袭数量并拍照,细胞 3.1 三虫通络散结方含药血清的最佳干预浓度筛选
侵袭数量越多说明侵袭能力越强。 结果
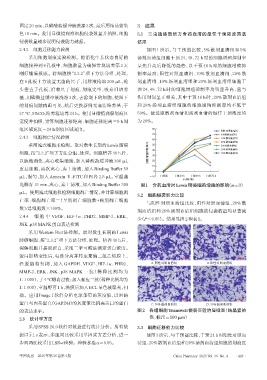
2.4.2 细胞迁移能力检测 如图 1 所示,与干预前比较,5% 散剂血清组和 5%
采用细胞划痕实验检测。将消化生长状态良好的 汤剂血清组细胞干预 24、48、72 h 时的细胞增殖抑制率
细胞接种到 6 孔板中,细胞数量为确保常规培养第 2 天 呈先升高后降低的趋势,以干预 48 h 时的细胞增殖抑
刚好铺满板底。将细胞按“2.3.2”项下方法分组、处理, 制率最高;阳性对照血清组、10% 散剂血清组、20% 散
在 6 孔板上方放置无菌的尺子,用移液枪取 200 μL,枪 剂血清组、10% 汤剂血清组和 20% 汤剂血清组细胞干
头垂直于孔板,沿着尺子划痕,划痕完毕,吸弃旧培养 预 24、48、72 h 时的细胞增殖抑制率均明显升高,且与
基,用磷酸盐缓冲液洗涤3次,去除划下的细胞,使留下 作用时间呈正相关,其中干预 48 h 时,20% 散剂血清组
的划痕间隙肉眼可见,然后更换新鲜无血清培养基,于 和 20% 汤剂血清组细胞的细胞增殖抑制率均不低于
37 ℃、5%CO2培养箱培养24 h。使用显微镜观察划痕区 50%。故选取散剂血清和汤剂血清的最佳干预浓度均
宽度并拍照,计算细胞迁移距离:细胞迁移距离=0 h划 为20%。
痕区域宽度-24 h划痕区域宽度。 80 阳性对照血清组
70 5%散剂血清组
2.4.3 细胞凋亡情况检测 10%散剂血清组
60 20%散剂血清组
采用流式细胞术检测。取对数生长期的Lewis肺癌 50 5%汤剂血清组
细胞,按“2.3.2”项下方法分组、处理。细胞培养48 h后, 细胞增殖抑制率/% 40 10%汤剂血清组
20%汤剂血清组
30
以胰酶消化,离心收集细胞,加入磷酸盐缓冲液 300 μL 20
10
重悬细胞,再次离心,弃上清液,加入 Binding Buffer 50
0
μL,混匀,加入 Annexin Ⅴ-FITC 和 PI 各 2.5 μL,室温避 -10 干预前 干预24 h 干预48 h 干预72 h
干预时间
光孵育 15 min,离心,弃上清液,加入 Binding Buffer 300 图1 含药血清对Lewis肺癌细胞增殖的影响(n=3)
μL。使用流式细胞仪检测细胞凋亡情况,并计算细胞凋
3.2 细胞侵袭能力比较
亡率:细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞
与阴性对照血清组比较,阳性对照血清组、20% 散
数)/总细胞数×100%。
剂血清组和 20% 汤剂血清组细胞的侵袭数量均显著减
2.4.4 细 胞 中 VEGF、HIF-1α、PHD2、MMP-2、ERK、
少(P<0.05)。结果见图2和表1。
JNK、p38 MAPK蛋白表达检测
采用 Western Blot 法检测。取对数生长期的 Lewis
肺癌细胞,按“2.3.2”项下方法分组、处理。培养48 h后,
裂解细胞并提取蛋白,采用二辛可酸法测定蛋白浓度。
蛋白加热变性后,电泳分离并转至聚偏二氟乙烯膜上,
经脱脂粉封闭,加入 GAPDH、VEGF、HIF-1α、PHD2、 A.阴性对照血清组 B.阳性对照血清组
MMP-2、ERK、JNK、p38 MAPK 一 抗(稀 释 比 例 均 为
1∶1 000),于4 ℃孵育过夜;加入相应二抗(稀释比例均为
1∶1 000),室温孵育1 h,洗膜后加入ECL显色液曝光,扫
描。应用 Image J 软件分析电泳条带的灰度值,以目的
蛋白与内参蛋白(GAPDH)的灰度值比值表示目的蛋白 C. 20%散剂血清组 D. 20%汤剂血清组
的表达水平。 图2 各组细胞Transwell侵袭实验的显微图(结晶紫染
2.5 统计学方法 色,标尺=100 μm)
采用SPSS 20.0软件对数据进行统计分析。所有数 3.3 细胞迁移能力比较
据以 x±s 表示,多组间比较采用单因素方差分析,进一 如图3所示,与干预前比较,干预24 h时阳性对照血
步两两比较采用LSD-t检验。检验水准α=0.05。 清组、20%散剂血清组和20%汤剂血清组细胞的划痕区
中国药房 2025年第36卷第4期 China Pharmacy 2025 Vol. 36 No. 4 · 443 ·