Page 47 - 中国药房2021年11期
P. 47
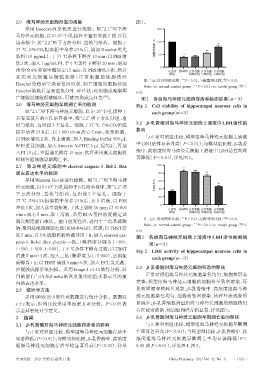
2.5 海马神经元细胞形态的观察 图1。
采用 Hoechst-PI 染色法进行观察。取“2.1”项下海 150
3
马神经元细胞,以5×10 个/孔接种于置有盖玻片的12孔
培养板中,按“2.2”项下方法分组、造模与给药。细胞于 % 100 ##
37 ℃、5%CO2恒温箱中培养 24 h 后,滴加 Hoechst 荧光 细胞存活率, ##
染料(10 μg/mL),于 37 ℃条件下孵育 10 min;以 PBS 清 50 **
洗3次,加入1 μg/mL PI,于4 ℃条件下孵育20 min;滴加
0
预冷的4%多聚甲醛固定15 min;以 PBS清洗3次,然后 正常对 模型组 β-乳香酸 β-乳香酸 β-乳香酸
照组 低浓度组 中浓度组 高浓度组
采 用 荧 光 倒 置 显 微 镜 观 察(正 常 细 胞 的 细 胞 核 经
##
注:与正常对照组比较, P<0.01;与模型组比较,P<0.01
**
Hoechst 染色后呈淡蓝色圆形状,凋亡细胞的细胞核经
##
Note:vs. normal control group, P<0.01;vs. model group,P<
* *
Hoechst染色后呈亮蓝色分叶、碎片状;死细胞或晚期凋 0.01
[15]
亡细胞因细胞膜被破坏,可被PI染成亮红色 )。 图1 各组海马神经元细胞存活率检测结果(n=3)
2.6 海马神经元细胞早期凋亡率的检测 Fig 1 Cell viability of hippocampal neurons cells in
3
取“2.1”项下海马神经元细胞,以5×10 个/孔接种于 each group(n=3)
具有盖玻片的 6 孔培养板中,按“2.2”项下方法分组、造
3.2 β-乳香酸对海马神经元细胞上清液中LDH活性的
模与给药,每组设3个复孔。细胞于37 ℃、5%CO2恒温
影响
箱中培养 24 h 后,以 1 000 r/min 离心 5 min,收集细胞,
与正常对照组比较,模型组海马神经元细胞上清液
以 PBS 清洗 2 次,弃上清液;加入 Binding buffer 500 μL
中LDH活性显著升高(P<0.01);与模型组比较,β-乳香
轻轻重悬细胞;加入 Annexin V-FITC 5 μL 混匀后,再加
入PI 10 μL,室温避光孵育15 min,然后采用流式细胞仪 酸中、高浓度组海马神经元细胞上清液中LDH活性均显
检测各组细胞早期凋亡率。 著降低(P<0.01),详见图2。
2.7 海马神经元细胞中 cleaved caspase-3、Bcl-2、Bax 100
**
蛋白表达水平的检测 80 ##
采用Western blot法进行检测。取“2.1”项下海马神 U/L 60
经元细胞,以5×10 个/孔接种于6孔培养板中,按“2.2”项 LDH, 40 ##
3
下方法分组、造模与给药,每组设 3 个复孔。细胞于
20
37 ℃、5%CO2恒温箱中培养 24 h 后,弃上清液,以 PBS
0
冲洗3次,加入适量裂解液,于冰上裂解30 min;以10 000 正常对 模型组 β-乳香酸 β-乳香酸 β-乳香酸
r/min 离心 5 min,取上清液,采用 BCA 蛋白浓度测定试 照组 低浓度组 中浓度组 高浓度组
注:与正常对照组比较, P<0.01;与模型组比较,P<0.01
##
**
剂盒测定蛋白浓度。蛋白经变性后,进行十二烷基硫酸
##
* *
Note:vs. normal control group, P<0.01;vs. model group,P<
钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜;以TBST清
0.01
洗5 min,以5%脱脂奶粉溶液封闭1 h;加入cleaved cas-
图 2 各组海马神经元细胞上清液中 LDH 活性检测结
pase-3、Bcl-2、Bax、β-actin 一抗、(稀释度分别为 1 ∶ 400、
果(n=3)
1∶ 500、1 ∶ 500、1 ∶ 500),于4 ℃条件下孵育过夜;以TBST
Fig 2 LDH activity of hippocampal neurons cells in
清洗 5 min×4 次,加入二抗(稀释度为 1 ∶ 5 000),室温振
each group(n=3)
荡孵育1 h;以TBST 清洗5 min×6次,加入 ECL发光液,
3.3 β-乳香酸对海马神经元细胞形态的影响
经凝胶成像系统扫描。采用Image J v1.44软件分析,以
目的蛋白与内参β-actin 的灰度值的比值来表示目的蛋 正常对照组海马神经元细胞染色均匀,细胞核形态
白的表达水平。 完整;模型组海马神经元细胞的细胞核呈致密浓染,可
2.8 统计学方法 见核固缩和核碎片现象;β-乳香酸中、高浓度组海马神
采用SPSS 19.0软件对数据进行统计分析。数据以 经元细胞染色均匀,细胞核致密浓染、核碎片状现象明
x±s 表示,组间比较采用单因素方差分析。P<0.05 表 显减少;β-乳香酸低剂量组海马神经元细胞的细胞核仍
示差异有统计学意义。 存在致密浓染,核固缩和碎片仍显著,详见图3。
3 结果 3.4 β-乳香酸对海马神经元细胞早期凋亡率的影响
3.1 β-乳香酸对海马神经元细胞存活率的影响 与正常对照组比较,模型组海马神经元细胞早期凋
与正常对照组比较,模型组海马神经元细胞存活率 亡率显著升高(P<0.01);与模型组比较,β-乳香酸中、高
显著降低(P<0.01);与模型组比较,β-乳香酸中、高浓度 浓度组海马神经元细胞早期凋亡率均显著降低(P<
组海马神经元细胞存活率均显著升高(P<0.01),详见 0.05 或 P<0.01),详见图4、图5。
中国药房 2021年第32卷第11期 China Pharmacy 2021 Vol. 32 No. 11 ·1321 ·