Page 91 - 《中国药房》2020年第24期
P. 91
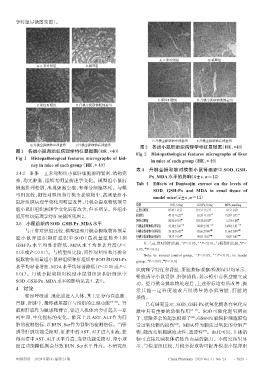
学特征显微图见图1。
A.正常对照组 B.模型组
A.正常对照组 B.模型组
C.阳性对照组 D.丹桃金提取物低剂量组
C.阳性对照组 D.丹桃金提取物低剂量组
E.丹桃金提取物中剂量组 F.丹桃金提取物高剂量组
E.丹桃金提取物中剂量组 F.丹桃金提取物高剂量组 图2 各组小鼠肝组织病理学特征显微图(HE,×40)
图1 各组小鼠肾组织病理学特征显微图(HE,×40)
Fig 2 Histopathological features micrographs of liver
Fig 1 Histopathological features micrographs of kid-
in mice of each group(HE,× 40)
ney in mice of each group(HE,× 40)
表 4 丹桃金提取物对模型小鼠肾组织中 SOD、GSH-
3.4.2 肝脏 正常对照组小鼠肝细胞排列紧密、结构完
Px、MDA水平的影响(x±±s,n=12)
整,均无肿胀,组织无明显病理学变化。模型组小鼠肝
Tab 4 Effects of Dantaojin extract on the levels of
细胞排列松散,出现细胞空泡,有部分细胞坏死。与模
SOD,GSH-Px and MDA in renal tissue of
型组比较,阳性对照组和丹桃金提取物中、高剂量组小
model mice(x±±s,n=12)
鼠肝组织病理学变化均明显改善;丹桃金提取物低剂量
组别 SOD,U/mg GSH-Px,U/mg MDA,nmol/mg
组小鼠肝组织病理学变化虽有改善,但不明显。各组小 正常对照组 87.45±11.53 119.31±15.37 4.15±0.50
鼠肝组织病理学特征显微图见图2。 模型组 47.15±6.22 ** 65.29±11.95 ** 15.29±0.75 **
阳性对照组 80.96±9.91 ## 107.74±9.58 ## 5.72±1.08 ##
3.5 小鼠组织内SOD、GSH-Px、MDA水平
丹桃金提取物低剂量组 52.14±7.56 **# 68.96±7.81 **# 14.96±1.41 **#
与正常对照组比较,模型组和丹桃金提取物各剂量 丹桃金提取物中剂量组 59.18±6.42 *# 85.66±9.94 *## 11.66±0.94 *##
组小鼠肾组织和肝组织中 SOD(高剂量组除外)和 丹桃金提取物高剂量组 74.27±9.54 ## 96.85±8.67 *## 8.62±0.67 *##
**
#
*
GSH-Px 水平均显著降低,MDA 水平均显著升高(P< 注:与正常对照组比较,P<0.05, P<0.01;与模型组比较,P<
0.05,P<0.01
##
0.05或P<0.01)。与模型组比较,阳性对照组和丹桃金
* *
Note:vs. normal control group, P<0.05, P<0.01;vs. model
*
提取物各剂量组小鼠肾组织和肝组织中SOD和GSH-Px group,P<0.05,P<0.01
##
#
水平均显著增加,MDA水平均显著降低(P<0.05或P<
织病理学特征和肾脏、肝脏指标观察/检测结果均显示,
0.01)。丹桃金提取物对模型小鼠肾组织和肝组织中
铅能诱导小鼠肾脏、肝脏损伤,提示铅中毒模型建立成
SOD、GSH-Px、MDA水平的影响见表4、表5。
功。经丹桃金提取物处理后,上述指标均有所改善,提
4 讨论 示其能一定程度地改善铅诱导的小鼠肾脏、肝脏的
铅经呼吸道、消化道进入人体,其主要分布在血液、 损伤。
肾脏、肝脏中,最终破坏器官与组织的生理功能 [19-20] 。肾 已有研究显示,SOD、GSH-Px抗氧化酶系在氧化应
脏和肝脏作为敏感靶器官,铅进入机体内会引起其一系 激中具有重要的防御作用 [21-22] 。SOD 可催化超氧阴离
列生理、生化指标的变化。临床上以 AST、ALT 作为肝 子,清除多余的超氧根离子 ;GSH-Px能保护细胞膜免
[23]
脏的检测指标,以BUN、Scr作为肾脏的检测指标。当铅 受过氧化物的损伤 。MDA 作为脂质过氧化的分解产
[24]
诱导肝脏功能受损时,肝脏中的AST、ALT进入血液,使 物,能改变细胞膜流动性、通透性 。由此可见,上述指
[25]
得血清中AST、ALT水平升高;当肾功能受损时,肾小球 标可直接反映机体清除自由基的能力。本研究结果显
滤过功能降低则会导致 BUN、Scr 水平升高。本研究组 示,与模型组比较,丹桃金提取物可提升模型小鼠肾组
中国药房 2020年第31卷第24期 China Pharmacy 2020 Vol. 31 No. 24 ·3029 ·